CRISPR-Cas9とは?原理をわかりやすく解説!
ゲノム編集ツールの中でも、世界中の研究室で使われているのがCRISPR-Cas9です。CRISPR-Cas9を活用することで、遺伝子研究はこれまで以上に加速しています。
そこで当記事では、CRISPR-Cas9が開発された経緯から特徴、原理、弱点の克服法などを解説します。原理を正しく理解することで、トラブルシューティングにも対応できるようになります。
CRISPR-Cas9の特徴を簡単にまとめると
CRISPR-Cas9(クリスパー・キャスナイン)とは、DNAの二本鎖切断を原理とする遺伝子改変ツールです。部位特異的ヌクレアーゼを利用するゲノム編集ツールの中でも、簡便で安価という特長があります。
CRISPR-Cas9は、ガイドRNA(gRNA)と、ヌクレアーゼであるCas9から構成されます。gRNAは、標的とするDNA配列を特異的に認識して結合し、Cas9を導きます。そして、Cas9がDNAの二本鎖を切断します。
細胞には切断されたDNAを修復する機構がありますが、正確に修復できずにエラーが発生することがあります。この修復エラーを利用して、遺伝子を改変します。
CRISPR-Cas9は、主に遺伝子の機能欠損(ノックアウト)のために使われます。ノックアウトだけでなく、DNAドナーテンプレートを同時に導入することで、標的遺伝子に新しい配列を組み込む(ノックインする)こともできます。
では、CRISPR-Cas9の歴史的背景や詳しい原理、そしてオフターゲット作用への対策を解説します。
CRISPR-Cas9の歴史と原理
CRISPR-Cas9の開発
CRISPR-Cas9はもともと、ファージ感染に対する細菌の免疫システムを明らかにする研究の中で生まれました。
CRISPRとは「Clustered regularly interspaced short palindromic repeats」の略で、細菌のDNAにある繰り返し配列のことです。1987年に石野良純博士(九州大学教授)らが発見しましたが、当時は大腸菌のもつ酵素の機能に関する論文の中で補足程度に述べるにとどまり、長らく注目されることはありませんでした*1。
その後、CRISPRリピート近傍にヌクレアーゼなどの酵素をコードする遺伝子群が存在することが明らかになり、その酵素はCas(CRISPR-associated)と呼ばれることになりました*2。
そして、ジェニファー・ダウドナ博士(カリフォルニア大学バークレー校教授)とエマニュエル・シャルパンティエ博士(マックス・プランツ・ユニット病原体学責任者、フンボルト大学名誉教授)が、化膿性レンサ球菌(Streptococcus pyogenes)において、CRISPRを含むRNAとCas9が外敵であるファージのDNAを切断する免疫システムであることを明らかにしました。
その上で、この原理をゲノム編集に応用することを提案しました*3。ダウドナ博士は論文を、その可能性への賛辞を込めた次のような言葉で締めくくっています。
“We propose an alternative methodology based on RNA-programmed Cas9 that could offer considerable potential for gene-targeting and genome-editing applications.”
訳:遺伝子ターゲティングとゲノム編集への幅広い応用可能性を秘めた、RNAによってプログラム可能なCas9を利用する代替的手法を、ここに提案する*4。
gRNAの構成と機能
gRNAは一本鎖RNAで、CRISPR RNA(crRNA)とtrans-activating crRNA(tracrRNA)から構成されます。
初期のCRISPR-Cas9ではcrRNAとtracrRNAを別々に導入したgRNA複合体が使われていましたが、現在では5’側にcrRNAと3’側にtracrRNAが連続する1つのRNA分子となっているシングルガイドRNA(sgRNA)を使用するアプローチが標準です(図1)。
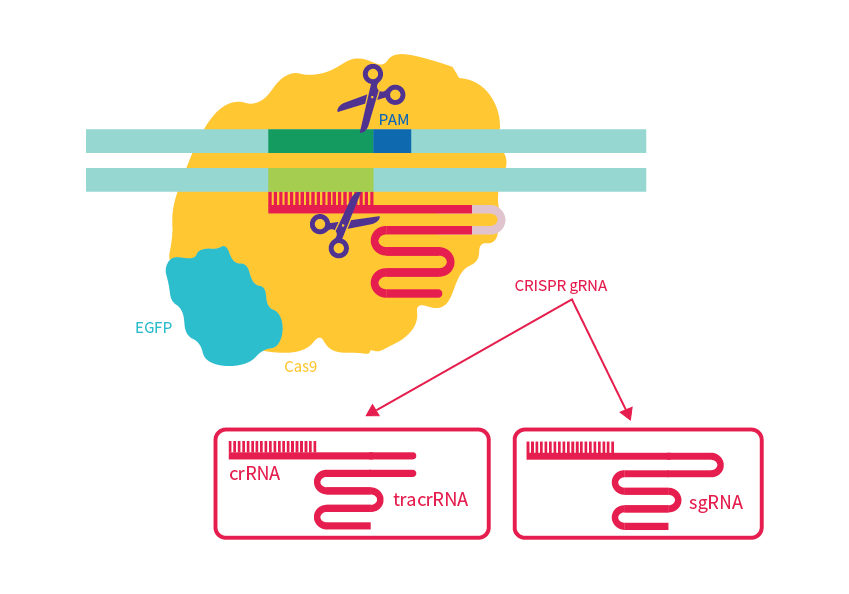
図1 CRISPR-Cas9によるゲノム編集システムの模式図。gRNAには2種類あるが、現在はcrRNAとtracrRNAが連結したsgRNAを用いるのが一般的。
crRNAは、標的DNA配列と相補的な配列にすることで、標的DNA配列を認識します。17〜20塩基から構成され、この部分を変えることで標的DNA配列を決定します。
ただし、標的DNA配列には制限があります。Cas9がDNAを切断するためには、標的領域の下流にprotospacer adjacent motif(PAM)配列が必要となります。
一般的に使用されている化膿性レンサ球菌由来のCas9(SpCas9)のPAM配列は5’-NGG-3’(Nは任意の塩基)ですが、黄色ブドウ球菌由来のCas9(SaCas9)は5’-NNGRRT-3’(RはAまたはG)と、由来する生物種によってPAM配列は異なります。
gRNAのもう1つの構成要素であるtracrRNAは、80塩基からなる配列です。Cas9をcrRNAと結合させるための足場として機能します。tracrRNAもCas9の種類により配列が異なります。例えばFrancisella novicida由来のCas9(FnCas9)はSpCas9と異なる配列のtracrRNAが必要です。
Cas9の2種類のヌクレアーゼドメインと機能
Cas9には2種類のヌクレアーゼドメインがあり、それぞれHNHヌクレアーゼドメインとRuvCヌクレアーゼドメインと呼ばれます。HNHヌクレアーゼドメインはcrRNAに相補的なDNA鎖を切断します。一方、RuvCヌクレアーゼドメインは非相補的なDNA鎖を切断します。
HNHヌクレアーゼドメインとRuvCヌクレアーゼドメインが協調することで、PAM配列の上流3塩基目と4塩基目の間でDNAの二本鎖切断(Double Strand Break、DSB)が生じます。
DNA修復機構を利用した変異の導入
DSBが生じると、細胞自身がもつDNA修復機構がDSBを修復しようとします。そのメカニズムには、非相同末端結合(Non-Homologous End Joining、NHEJ)と、相同組換え(Homology-directed Repair、HDR またはHomologous Recombination、HR)の2種類があります(図2)。
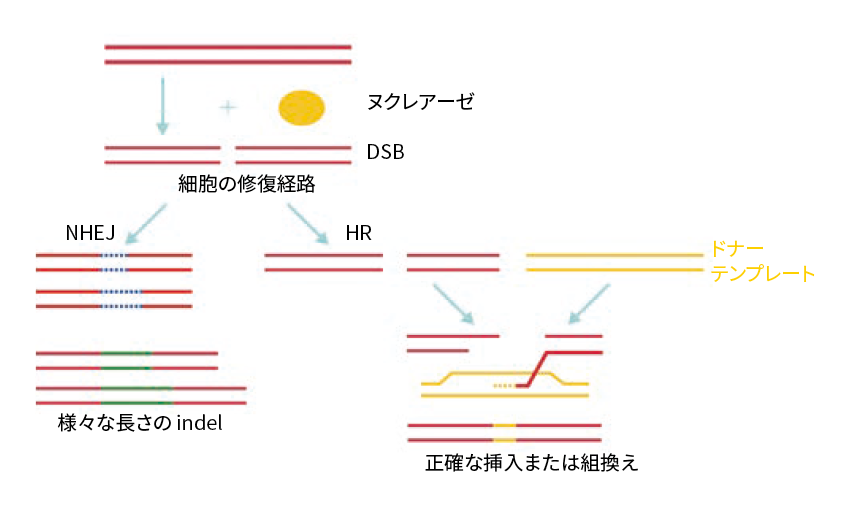
図2 Cas9ヌクレアーゼによって生じたDSBは、細胞が備えているNHEJまたはHR(HDR)というDNA修復機構によって修復される。NHEJではindel が生じ、HRでは外来性のドナーテンプレートを導入することで、任意の配列の挿入や組替えが可能。
NHEJは、DSB修復メカニズムとして主要なものです。切断されたDNAの末端が再結合する際、一定の確率で数塩基の挿入または欠失(insertion/deletion、indel)によるエラーが生じます。3の倍数以外のindelはフレームシフトや早期終始コドンによって機能欠損変異を引き起こすため、これを利用して標的遺伝子をノックアウトできます。
一方、gRNAとCas9を細胞に導入する際、挿入したいドナーテンプレートも導入すると、切断配列の中にDNAを挿入できます。HRによるDSB修復が起こるときに、ある頻度でドナーテンプレートを参照して修復が行われるためで、その結果、標的遺伝子に新しい配列が組み込まれます(ノックイン)。あるいは、まったく新しい遺伝子を導入することもできます。
CRISPR-Cas9が生命科学研究で好まれているのは、この原理によって簡便かつ安価に標的遺伝子をノックアウト・ノックインでき、細胞レベルや個体レベルで遺伝子の機能を調べることができるからです。
他のゲノム編集ツールとの違い
ゲノム編集ツールといえば、CRISPR-Cas9の他にもZFNとTALENがあります。
ZFNは1996年に開発された最初のゲノム編集ツールであり、DNA配列を認識して結合するジンクフィンガードメインとDNA切断ドメインから構成されます。シグマアルドリッチからもカスタム合成サービスが提供されています。
TALENは2010年に発表され、DNA配列の認識を34アミノ酸で行います。いずれも、DNA認識ドメインをアミノ酸ベースで合成し、さらにDNA切断ドメインを連結させる必要があります。準備期間の長さやコスト負担の大きさが課題ですが、オフターゲットの少ない正確な遺伝子編集が可能であり、ゲノム編集という技術そのものを研究テーマとする研究者の間で使用されています。
これらに対してCRISPR-Cas9は、DNA配列を認識するのがアミノ酸ではなくRNAであることが最大の特徴です。比較的合成しやすく、DNA切断を担うCas9と結合させる必要がないため、準備期間やコストが大幅に削減できます。一方、オフターゲット作用はZFNやTALENよりも起こりやすいとされています。ただし、後述するように、CRISPR-Cas9でオフターゲット作用を低減するための工夫もあります。
CRISPR-Cas9の特徴のまとめ
ここまでに述べたCRISPR-Cas9の特徴をまとめると、次のようになります。
- CRISPR-Cas9は標的配列を認識するgRNAと、ヌクレアーゼであるCas9、PAM配列を利用する
- Cas9によってDSBが生じ、NHEJによるノックアウトまたはHRによるノックインによって遺伝子を改変する
- 他のゲノム編集ツールに比べて簡便で、準備期間やコストが大幅に削減できる
CRISPR-Cas9の問題点と解決策
CRISPR-Cas9の特長は、他のゲノム編集ツールであるZFNやTALENと比べ、圧倒的な簡便さと安価であることです。培養細胞だけでなく、受精卵にゲノム編集を行うことでノックアウト個体も作製できます。
以前は、ノックアウト個体を作製するためにはES細胞で遺伝子組換えを行い、胚に移植して掛け合わせを繰り返す必要がありました。ゲノム編集であれば、そうした手間をかけず、短期間でノックアウト個体を作製できます。
一方、CRISPR-Cas9は、標的DNA領域以外でも改変を起こしてしまうオフターゲット作用が、ZFNやTALENと比較して生じやすいとされています。
CRISPR-Cas9のオフターゲット作用を低減させる方法はいくつかあります。
Cas9点突然変異を導入しRuvCヌクレアーゼドメインを不活化させたもの(Cas9-D10A、CRISPRニッケース)を用いると、crRNAの標的鎖だけを切断できます*5。 CRISPRニッケースと、近接した異なる位置を標的とするgRNAを2種類用意することで、近接領域の2か所のニックがDSBとなります(図3)。
このように2つのCRISPRニッケースをペアにしてはたらかせると特異性が上がり、オフターゲット作用を抑制できます。
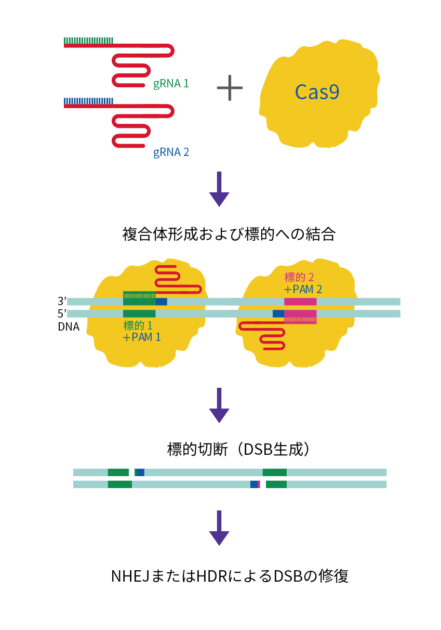
図3 ニッケースのペアがDSBを生成する様子を示した模式図。ニッケースのペアが近接する2箇所のDNAを認識し切断することでオフターゲット作用を低減できる。
また、SpCas9に点突然変異を3箇所入れて特異性を高めたeSpCas9を用いる方法もあります*6。
Cas9の由来する生物種によってPAM配列が異なることを利用してオフターゲット作用を避ける手もあります。 SpCas9のPAM配列である5’-NGG-3’よりも、SaCas9のPAM配列である5’-NNGRRT-3’のほうが偶然一致する確率が低くなるため、SaCas9を使用することでオフターゲット作用を避けられる可能性があります。
まとめ
この記事では、CRISPR-Cas9の原理や特徴について解説しました。簡便で安価であることが、他のゲノム編集ツールと比べて世界中で使われている理由です。
一方で、オフターゲット作用を考慮する必要があるなど、決して万能なツールではありません。原理を正しく理解することで、予期しない結果に備えることができます。
メルクでは、CRISPR-Cas9についてまとめた無料の日本語ガイドとカタログを用意しております。CRISPR-Cas9実験の際にはぜひ参考にしてください。
製品リストやご注文、お問い合わせ先などは以下のページに掲載しております。
遺伝子編集ツール-機能性ゲノミクス製品の日本国内でのご注文方法
また、CRISPR-Cas9の導入方法(プロトコール)についてはこちらをご覧ください。
<References>
*1 Y Ishino, et al. J Bacteriol. 1987;169(12):5429-33.
*2 R Jansen, et al. Mol Microbiol 2002;43(6):1565-75.
*3 M Jinek et al. Science 2012;337(6096):816-21.
*4 ジェニファー・ダウドナら著、櫻井祐子訳『CRISPR(クリスパー) 究極の遺伝子編集技術の発見』(文藝春秋)
*5 J Lamberth et al. BioRxiv 2019:766493.
*6 IM Slaymaker et al. Science 2016;351(6268):84-8.

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




