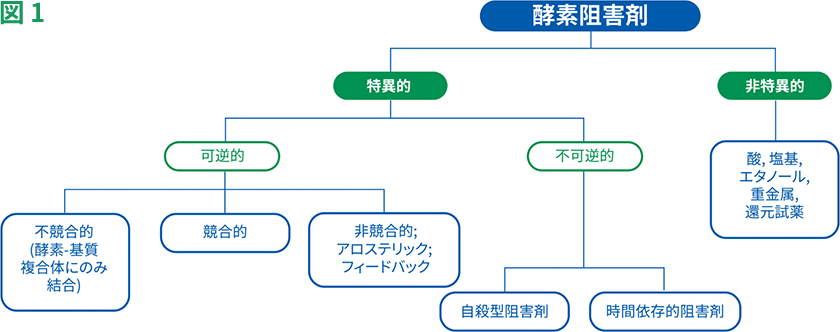
酵素阻害剤の分類と様々な可逆的阻害剤
酵素阻害剤の分類
酵素は触媒的な性質があり、反応への関与によって酵素自体が変化することなく、反応速度を加速します。酵素の反応触媒能は、様々な低分子(阻害剤)が活性部位、または活性部位から離れた部位に結合することによって減少します。
酵素活性は、多くの要因に依存しています。酵素活性に影響を及ぼすもっとも重要な要因は、酵素濃度、酵素に特異的な基質の量、反応液のpH、温度、そして活性化因子や阻害剤の有無です。
酵素阻害剤は通常、酵素と結合して酵素-阻害剤複合体を形成する低分子化合物で、酵素の触媒活性を低下、または完全に阻害し、反応速度を低下させます。酵素活性部位への阻害剤の結合は、その部位への基質の進入を防ぐことができます。
また、いくつかの阻害剤は活性部位以外の部位に結合し、酵素の立体構造変化を促し、活性部位への基質の進入を防ぎます。酵素に対する相互作用のタイプに基づいて、阻害剤の結合は可逆的または不可逆的のいずれかに分類することができます(図1)。
一般的な酵素阻害剤の分類
本記事ではこの中でも可逆的阻害剤とその詳しい分類について紹介します。
可逆的阻害剤
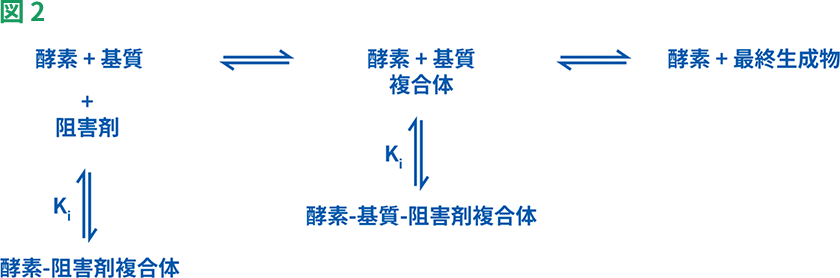
可逆的阻害剤は、競合的、非競合的、不競合的阻害剤の3つに分類することができます。これらの阻害剤は、水素結合、イオン結合や疎水性相互作用などの非共有結合によって酵素に結合します(図2)。
一方、不可逆的阻害剤は、酵素と共有結合して化学変化を促し、酵素活性に必要な主要なアミノ酸を修飾します。
また、酵素が複数の基質に作用する場合、基質によって阻害の種類が異なる場合があるという点に注意しましょう。これは、活性部位に、各基質に対して別々の結合部位が存在する場合があるためです。そのような場合、阻害剤は、1つ目の結合部位では基質Aと競合し、2つ目の結合部位では基質Bと非競合的に作用することがあります。
一般的な可逆的酵素阻害のスキーム
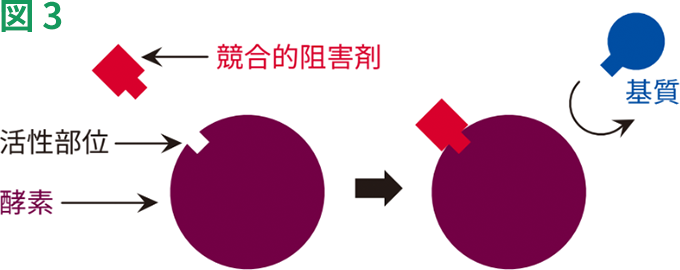
競合的阻害剤
競合的阻害では、阻害剤が天然の基質と構造的に類似しており、活性部位に接近するために基質と競合します(図3)。阻害剤は、活性部位に親和性があります。阻害剤が、基質よりも強力に活性部位に結合する場合、その阻害剤は効果的な競合的阻害剤となります。逆に、結合があまり強力ではない場合は、弱い阻害剤であるとみなされます。
競合的阻害では、阻害剤は遊離している酵素にしか結合できず、酵素-基質複合体には結合できません。このため、反応液中の基質濃度を高めることにより、阻害を克服することができ、基質量で阻害剤の結合を打ち負かすことによって、反応はVmaxに到達することができます。しかし、阻害剤の存在下でVmaxに到達するためには、基質濃度を高める必要があるため、Km値が高まります。
単純化した競合的阻害モデル
競合的阻害では、阻害定数であるKiを決定することができ、これは酵素-阻害剤複合体の解離定数を指します。Ki値が低いほど、反応速度の低下に必要な阻害剤量が少なくなります。この関係は次のように単純化することが可能です。
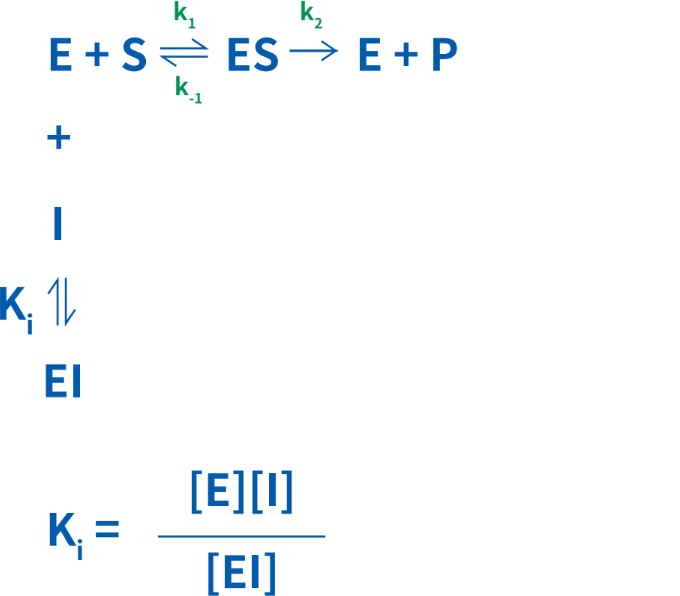
競合的阻害剤の作用を研究する場合は、インキュベーション液に適量の基質を加えましょう。基質の量が過剰だと、阻害剤を打ち負かしてしまいます。阻害剤を加えない対照実験も必ず実施してください。
競合的阻害の結果は、Lineweaver-Burkプロットで表すことができます(図4)。競合的阻害によってKmが高くなるため、阻害剤の存在下ではX切片が起点に近づきます。阻害剤の濃度を高めるにつれ、Kmがさらに高くなり、X切片はより起点に近づきます。競合的阻害剤はVmaxには影響を及ぼさないため、すべての線が同一のY切片を通っていることに注目してください。
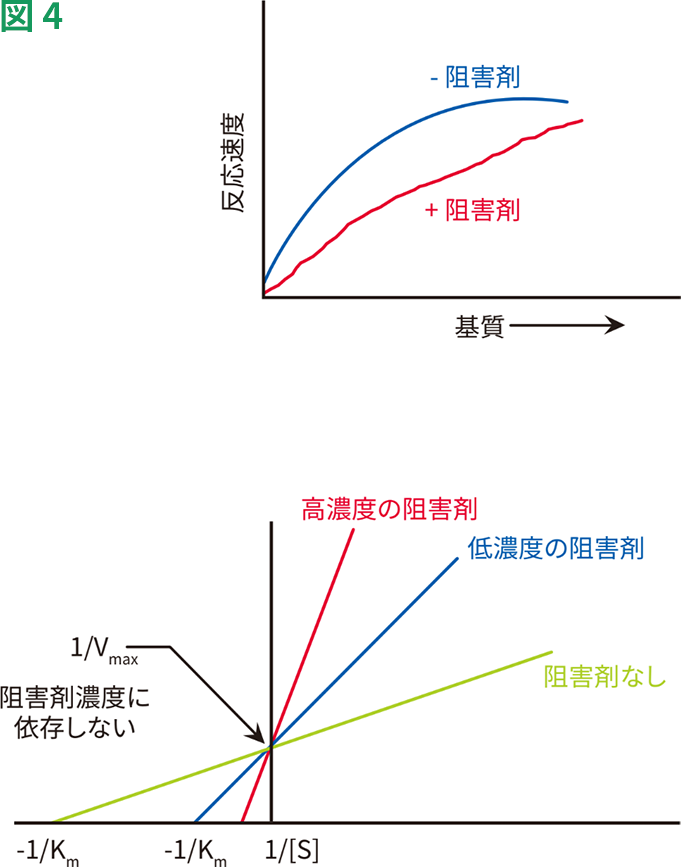
競合的阻害の動態
競合的阻害剤の例として、抗癌剤であるメトトレキサートが挙げられます。メトトレキサートは、テトラヒドロ葉酸の合成に関与する酵素であるジヒドロ葉酸還元酵素の活性を阻害します。もうひとつ例を挙げると、クエン酸シルデナフィルがあります。これはサイクリックGMP(cGMP)と構造的に類似しており、ホスホジエステラーゼVの活性を競合的に阻害し、結果として蓄積するcGMPによって平滑筋の弛緩を引き起こします。
酵素は、部分的に競合的阻害の動態を示すこともあります。このプロセスは競合的阻害と似ていますが、酵素-基質-阻害剤複合体(ESI)が部分的に活性を示します。このタイプの阻害では、Vmaxが低くなりますが、Kmは影響を受けません。完全な競合的阻害では、阻害剤の濃度が高くなると反応速度が0に近づく傾向がありますが、部分的阻害では、酵素が変化するものの、依然としていくらか機能的な酵素-基質-阻害剤(ESI)複合体が形成されます。
不競合的阻害剤
不競合的阻害剤は、酵素-基質複合体にのみ結合します。不競合的阻害と非競合的阻害を混同しないようにしましょう。不競合阻害剤は、酵素の活性部位には結合せず、基質との類似性を持つ必要はありません。不競合的阻害では、活性化された酵素-基質複合体がなくなるため、Vmaxが低下します。ESI複合体の量は阻害剤の濃度に依存します。ES複合体がなくなることにより、Kmも低下します。
不競合的阻害ではKmおよびVmaxが、同時に同じ速さで低下します。言い換えると、Vmax/Kmは変化しません。図5は、不競合的阻害剤により、1/Vmaxが高くなり、Y切片が上に移動することを示しています。阻害によって、曲線の勾配であるKm/Vmax比が維持される限り、1/Kmも高くなります。このため、不競合的阻害のLineweaver-Burkプロットは、阻害剤の有無で並行になります。
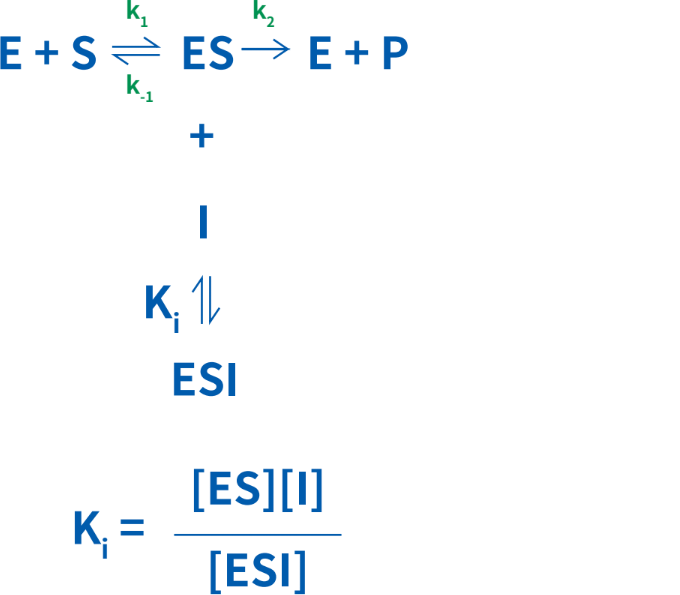
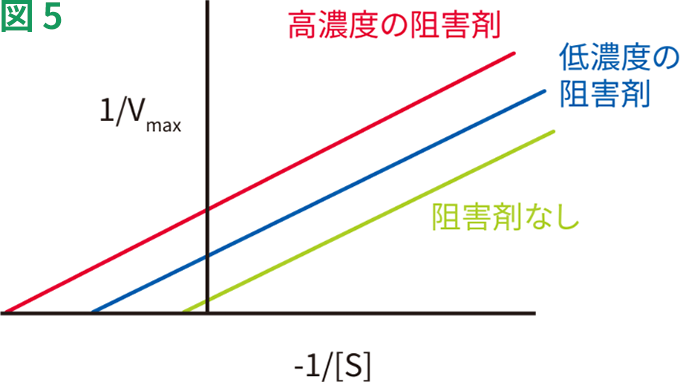
不競合的阻害の動態
不競合的阻害は比較的稀に、多量体酵素系で起こることがあります。不競合的阻害は進化的に重要です。なぜなら、代謝経路における不競合的阻害は競合的阻害よりも、代謝中間体の濃度に大きな影響を及ぼし、毒性を増すことがあるためです。不競合的な可逆的阻害剤の例に、乳酸脱水素酵素を阻害するシュウ酸塩があります。
混合型阻害剤
阻害剤が、遊離している酵素(解離定数Ki)と、酵素-基質[ES]複合体(解離定数K’i)の両方に結合できる場合があります。しかし、親和性は異なるため、Ki≠K’iとなります。この場合、より多くの基質を加えることにより阻害剤の結合は減少しますが、競合的阻害のように阻害を完全に克服することはできません。混合型阻害剤は結合に干渉し、代謝回転の有効性を低下させます。
この種の阻害は性質的に主にアロステリック(後述)で、阻害剤が活性部位以外の部位に結合し、酵素の立体構造変化を引き起こすことによって、活性部位に対する基質の親和性を低下させます。このため、Kmが高くなる一方でVmaxは低下します(図6)。混合型阻害の例には、パラジウムイオンによるキサンチンオキシダーゼの阻害があります。
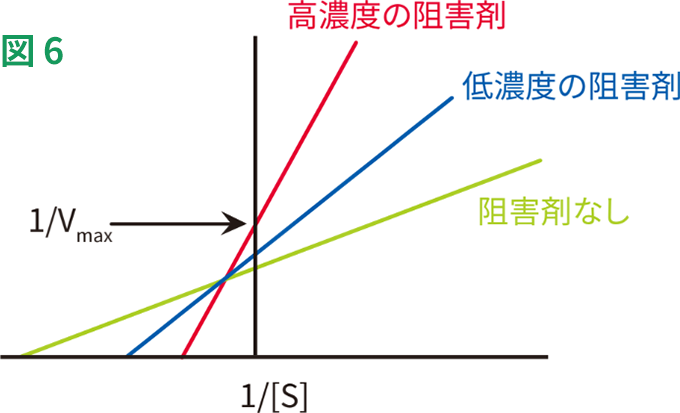
混合型の阻害の動態
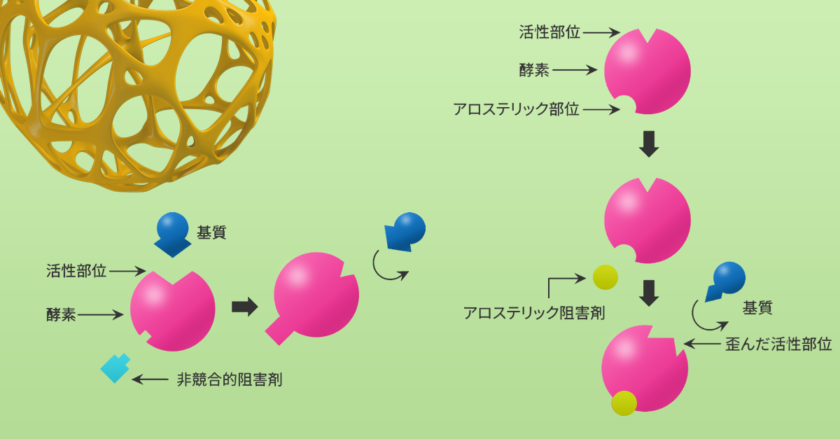
非競合的阻害剤
非競合的阻害では、阻害剤の結合によって酵素活性が低下しますが、基質の結合には影響しません(図7)。このため、阻害の程度は阻害剤の濃度にのみ依存します。これらの阻害剤は、基質結合部位以外の部位に非共有結合的に結合します。阻害剤の結合によって、基質の結合部位の利用能が影響を受けることはありません。このため、基質や阻害剤の結合は互いに独立しており、基質濃度を高めても阻害を克服することはできません。
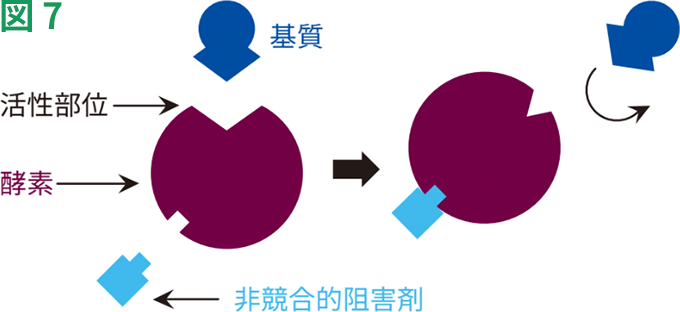
単純化した非競合的阻害モデル
非競合的阻害剤は、酵素にも酵素-基質複合体にも同一の親和性を示すため、Ki= K’iとなります。このため、Vmaxは低くなりますが、Kmは影響を受けません。非競合的阻害剤の存在下では、阻害剤が存在しないときのVmaxに到達することはできません。非競合的阻害の平衡は、次のように単純化することができます。
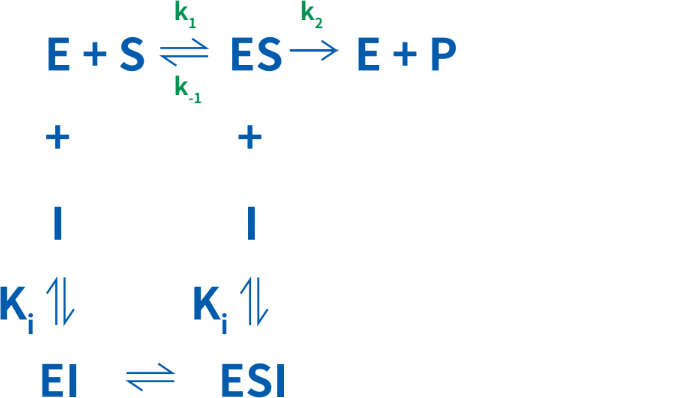
非競合的阻害剤の作用を、図8にグラフで表します。Y切片は1/Vmaxであるため、Vmaxが低下するにつれ、1/Vmaxが高くなります。しかし、Kmは非競合的阻害剤の濃度に関わらず同一のままです。このため、すべての線は同一のX切片を通ります。非競合的な可逆的阻害剤の例は、ジギタリスです。ジギタリスはNa+-K+ATPアーゼの活性を阻害し、不整脈の治療に用いられています。
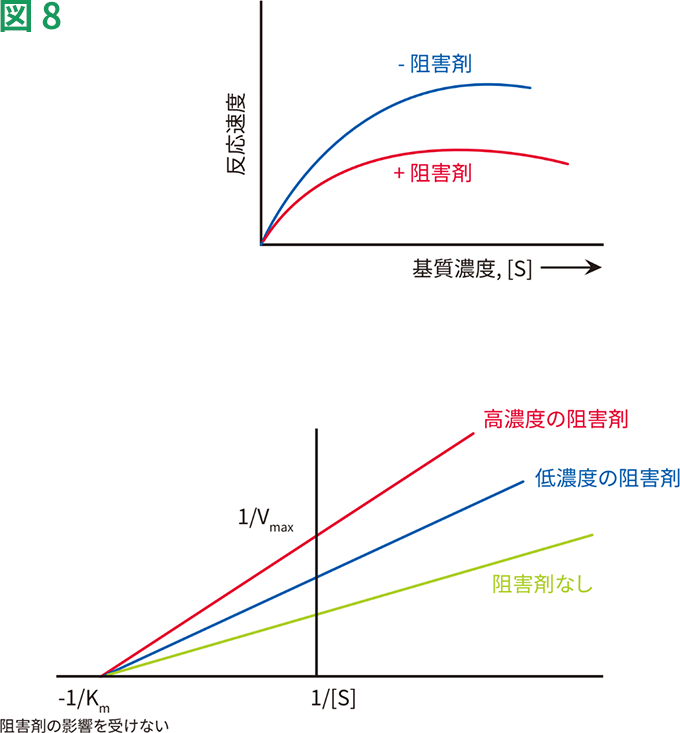
非競合的阻害の動態
アロステリック阻害剤
アロステリック酵素は、ミカエリス・メンテン速度式に従わない酵素の一群に属しています。一般的にアロステリック酵素は、細胞内で調節的な役割を果たしています。アロステリック酵素は、エフェクター分子(活性化因子や阻害剤)が調節部位に可逆的に、非共有結合することによって機能します。活性化因子の結合は、活性型の形状および酵素活性を促進しますが、阻害剤が調節部位に結合すると、アロステリック酵素は不活性型の形状をとり、活性が低下します(図9)。
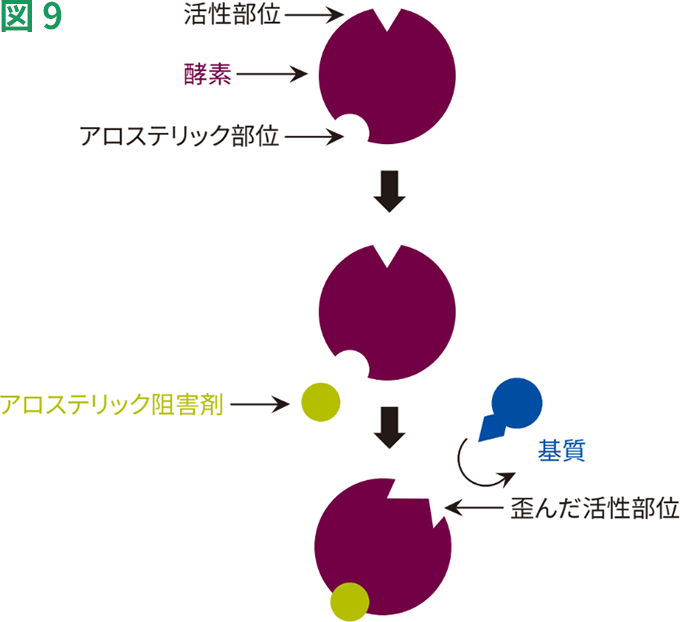
アロステリック阻害のモデル
これらの動態は、双曲線ではなくS字型の曲線になります。これは、これらの酵素が複数の結合部位を有しており、複数の基質分子に結合することができるためです。[S]が十分に高いと、基質による飽和が認められます。このようなS字型の反応曲線では、ミカエリス・メンテンモデルが適用されないため、反応速度が最大速度の半分になる基質濃度をKmとすることはできません。反応速度が最大速度の半分になる基質濃度を表すため、代わりのシンボルとして[S]0.5またはK0.5が用いられます。
アロステリック阻害は、1つのリガンドの結合によって、その他の活性部位における基質への親和性が低下する場合に起こります。アロステリック阻害の古典的な例は、ホスホフルクトキナーゼ(PFK)の阻害です。PFKは、フルクトース-6-リン酸のリン酸化を触媒し、フルクトース-1-6-ビスリン酸を産生します。ATP濃度が上昇すると、PFKの活性はアロステリックに阻害されます。ATPがPFKのアロステリック部位に結合し、酵素の形状を変化させます。これによって活性部位におけるフルクトース-6-リン酸やATPへの親和性が低下し、解糖の速度が低下します。
アロステリック酵素の活性型と不活性型は、基質と阻害剤の相対濃度に依存して平衡に存在しています。アロステリック阻害剤の結合により、酵素は不活性型の高次構造をとり、第2の阻害剤の協同的結合を促進することもあります。
最終生成物阻害剤
多くの酵素触媒反応は経時的に起こり、生化学的経路では、1つの反応の産物が、次の反応の基質になります。経路の最終産物が必要以上に蓄積すると、この最終産物が最初の酵素の活性を阻害することがあります。経路の最終産物が、経路の最初の酵素のアロステリック部位に結合すると、経路の活動が停止します(図10)。結合によって酵素に立体構造変化が生じ、最初の基質と反応することができなくなります。これは、産物の過剰な蓄積を防止する生物学的制御の一形態です。この例は、L-スレオニン脱水酵素が触媒するL-スレオニンからL-イソロイシンへの変換です。L-スレオニン脱水酵素は、L-イソロイシンによって強力に阻害されます。
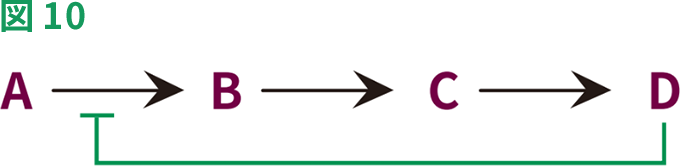
最終生成物による阻害では、経路の最終生成物(D)が、AをBに変換する酵素に直接結合(および阻害)し、これによって経路の活動を停止させます
以上、酵素阻害剤の分類と、可逆的阻害剤の種類について解説しました。それぞれの阻害剤の仕組みと、それがどのように反応速度に影響するかについて、よく確認しておきましょう。
<無料PDFダウンロード> 阻害剤 選択ガイド
この阻害剤選択ガイドでは、酵素に対する阻害剤や受容体への阻害剤の作用機序について解説し、適切な阻害剤選びに役立つ情報をご紹介しています。
▼こんな方にオススメ
・最適なプロテインキナーゼ阻害剤を選びたい方
・各種シグナル阻害剤の背景知識を学びたい方
・これから阻害剤を使った実験を行う可能性がある方

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




