pHと酸解離定数pKaの関係(バッファーの基礎知識)

バッファーの基礎知識
化学やライフサイエンスの実験を成功させるためにはpHをコントロールすることが重要です。そのためには、バッファーの性質をしっかりと理解して利用する必要があります。この記事では、バッファーの基礎知識であるpHとpKaの関係について説明します。
まずは基礎中の基礎、pHの定義から復習していきましょう。
pHの定義と計算方法
pHの値が小さいと酸性で、大きいと塩基性ということは知っていても、pHの定義を述べよと言われるとすぐには答えられない人もいるかもしれません。
pHは「水素イオン指数」のことで、水素イオン濃度の逆数の対数で表される数値です。(式①)
pHの値は0から14までしかとりませんが、これは水のイオン積[H+][OH-]が1気圧25℃においてほぼ一定であることに基づいています。(式②)

バッファーのpHが変化しない仕組み
バッファーは酸や塩基を多少加えてもpHをあまり変化させない性質をもっています。
このような性質をもつバッファーは通常、弱酸とその強塩基の塩の混合、もしくは弱塩基とその強酸の塩の混合で構成されています。
たとえば、酢酸と酢酸ナトリウムを混合した酢酸バッファー、リン酸二水素ナトリウムとリン酸水素二ナトリウムを混合したリン酸バッファー、アンモニアと塩化アンモニウムを混合したアンモニウムバッファーなどがあります。
酢酸バッファーを例にとると、溶液中では③のような酸解離平衡が起こっています。
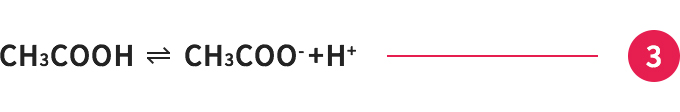
この溶液に酸を加えた場合、加えられた水素イオンは酢酸イオンと反応して酢酸となり、平衡は左方向へ移動します。結果として、水素イオンの濃度は増加せず、pHは変化しません。
また、このバッファーに強酸を加えた場合、加えた強酸と同じ量の酢酸イオンが中和され、酢酸イオンが減少し、酢酸は増加しますが、水素イオン濃度はそこまで変化しません。よって、pHの変化も小さくなります。
生体内における水とバッファーの役割
全ての生物学的反応は水性溶媒中で起こります。これは、細胞の構造と機能が、水の物理的性質と化学的性質に依存することを意味しています。水はほぼ全ての塩を溶解し、解離した陽イオンと陰イオンを水和して安定化する役割をもち、生体反応の基盤を作る極性溶媒です。
組織内には水分子と共に弱酸と弱塩基が存在します。弱酸や弱塩基は溶液中で完全に解離せず、非解離状態である分子と解離状態であるイオンの平衡混合物の状態をとります。このイオン化反応の指標の一つが、イオン化定数あるいは解離定数と呼ばれる平衡定数であり、弱酸や弱塩基による緩衝作用の指標でもあります。生体内は、複数の酸と塩基がバッファーとして機能する緩衝系なのです。
酸解離定数pKaとは何か
酸の強さは水溶液中での解離のしやすさで決まります。塩酸は、水素イオンを放出しやすいので強酸で、酢酸は放出しにくいので弱酸です。この解離のしやすさを表す数が酸解離定数(Ka)です。これはそれぞれの酸に固有の定数です。
酸をHAで表すと、その電離平衡は式④のようになり、酸解離定数は式⑤で計算できます。

水素イオンを放出しやすい強酸は[H+]が大きくなるのでKaの値は大きくなります。逆に弱酸は小さくなります。
酸解離定数についてもpHと同じく、Kaの逆数の対数をpKaで表します。
pKa=-logKa
この式より、酸が強いほど、pKaは小さい値をとります。
pHとpKaの関係を表すヘンダーソン-ハッセルバルヒ式
酸解離定数の式⑤からpHとpKaの関係を考えてみましょう。
⑤の両辺logをとり(⑥)、右辺を分けて(⑦)、-logKa=pKaと-log[H+]=pHをあてはめると、式⑧が出来上がります。
この式⑧をヘンダーソン-ハッセルバルヒ式と呼びます。
<ヘンダーソン-ハッセルバル式の導出方法>
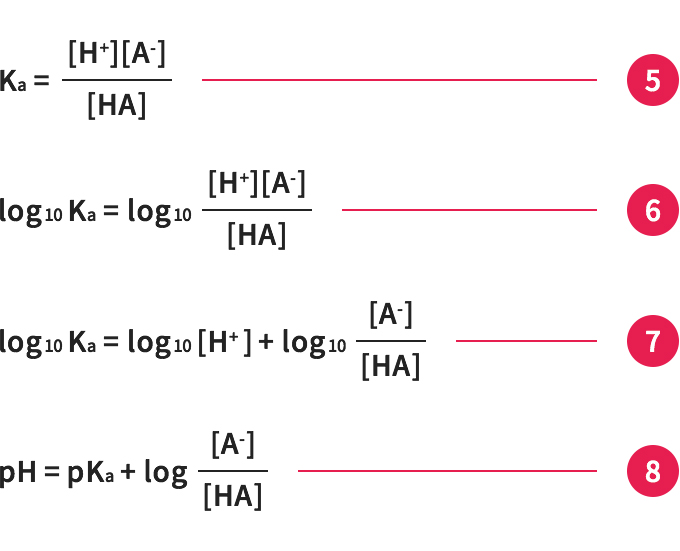
pKaは溶媒や温度の条件が定まれば、酸に固有の値をとります。したがって、この式を使うと緩衝液のpHを見積もることができます。
たとえば酢酸の場合、酢酸イオン濃度と酢酸濃度が等しい時、つまり50% の分子が電離している時、右辺の分母と分子は1に近づき、log1はゼロなので、pHはpKaに等しくなります。一般的に、弱酸あるいは弱塩基のpKa は緩衝領域中心のpH を示します。
等電点とpKa
バッファーは可逆的に反応する弱酸(プロトン供与体)とその共役塩基(プロトン受容体)から構成される緩衝系で、両者の濃度がほぼ等しい溶液では、前述の通り少量の酸や塩基の添加はpH にほとんど影響を及ぼしません。このようにプラスの電荷とマイナスの電荷がちょうどつりあっている点を等電点といいます。等電点では正味電荷がなく、pH = pKa となります。
等電点は物質によって違いがあるため、ライフサイエンスの研究では、等電点電気泳動などの手法で、分子量が同じで等電点が違うタンパク質を分離したり、未知の物質の等電点を測定して物質の性質を調べたりするのに利用できます。
pH に対する温度の影響
一般的に、分子の緩衝作用を考えるときは、Kaは一定であることを前提としています。ですが、実際には、pKa は温度変化に対して一定ではなく、温度の上昇と共に値がわずかに小さくなる事が知られています。
pKa の変動はpHにも影響を与えるため、正確な水素イオン濃度が要求される生体システム中において、温度は非常に重要になってきます。
下の図は、リン酸バッファーのpH の温度による影響を示しています。
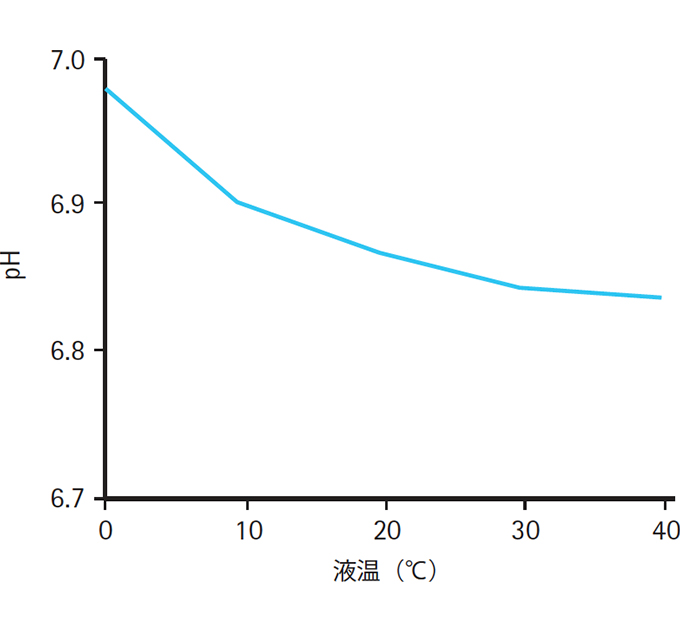
5℃のときpH=6.95で、40℃ではpH=6.84です。小さな差異に見えるかもしれませんが、このわずかな変化が、生体内の化学反応に大きな影響を与えます。バッファー使った実験をするときは、pHだけでなく温度にも気をつけるようにしましょう。
以上、pHとpKaについて復習しました。
実験がどうしてもうまくいかないときは、原点に返って、バッファーから見直してみてはいかがでしょうか。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須