水のpH値とは?純水や超純水のpH測定が難しい理由
※2022年11月7日に記事を加筆・編集しました。
水のpH値とは
ライフサイエンスの実験や試験、さまざまな分析に欠かせない水。そのpHがどのくらいか知っていますか。pHは溶液中の水素イオン濃度を示す単位で、溶液の酸性・アルカリ性の程度を表します。pHは0.0から14.0で表され、pH7.0が中性、7.0より大きい場合はアルカリ性、小さい場合は酸性となります。
「超純水」のpHの理論値は7.0です。しかし、空気と接触することにより、空気中の二酸化炭素を吸収してしまうと、酸性を示すこともあります。
飲料水に最適なpH値はどのくらい?
pH が8以上の場合には塩素消毒の効果が低下することから、WHOは「効果的な塩素消毒を行うためには、pH8未満であることが望ましい」としてます*3。また、pHが10以上で炊飯するとごはんが黄色く変色するなどの影響があります。一方で、pH値が低く、酸性が強すぎる場合は、凝集剤の効果に悪影響を与え、水道管の腐食や劣化を引き起こすことがあります*2。このように酸性・アルカリ性のどちらにpHが傾いても、水道施設の腐食など私たちの日常生活に影響が出ることから、水道水の水質基準は、pH5.8以上8.6以下とされており、水質管理目標値は7.5程度とされています*1,2。
また、ミネラルウォーターの成分規格は、水道水と同様にpH5.8以上8.6以下です。極端なpH値の飲料水の流通を防止するために、水道法で定められた水質基準に準じた値となっています*3。
pH値の測定方法
pH値を測定する方法は、次の3つに大きく分けられます。
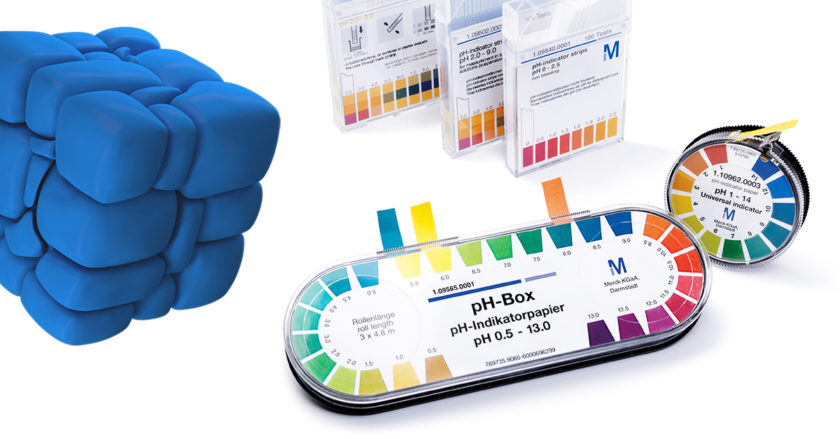
・指示薬法
緩衝液などを用いてさまざまなpH値に対応する標準色を準備し、この標準色と測定したい溶液に指示薬を滴下したときの色を比較する方法です。紙に指示薬を染み込ませたpH試験紙をサンプルに浸して、色を標準色と比較する方法もあります。ただ指示薬法は誤差があるため、高精度の測定はできません*4。
・ガラス電極法
ガラス電極と比較電極の電位差でpHを測定する方法です。再現性がよく、酸化剤や還元剤の影響を受けることも少ないことから、最もよく用いられているpH測定法です*4。
・半導体センサーによる測定
ガラス電極の機能を半導体チップで実現したpHセンサーを利用したpH測定法があります。ガラスを用いないので割れにくく、小型化・微小化が可能というメリットがあります*4。
純水・超純水のpH値を測定するのが難しい理由
実験、試験、分析には欠かすことができない「純水」と「超純水」。不純物をまったく含まない純水や超純水のpH値は理論上7.0となるはずですが、実際にpHメーターで純水を測定してみると、酸性やアルカリ性を示すことがあります。基本的な操作であるにも関わらず、なぜこうしたブレが起こるのでしょうか。純水の理論pHを化学式と数学的なアプローチから、その手がかりを確認してみましょう。
まず、水がイオンに解離している反応を式で表すと次のようになります。
H2O→H+ + OH-
電解質をまったく含まない水(超純水)は平衡状態を保っています。この電離平衡を、平衡定数Kを用いて質量作用の法則で書き直すと次のようになります。
K=[H+]・[OH-]/[H2O]
この式から導き出されるのが、水の解離定数KWです。
[H+]・[OH-]=K・[H2O]≡KW
次に、温度に対する水の解離定数を表1に示します。
表1:水の解離定数
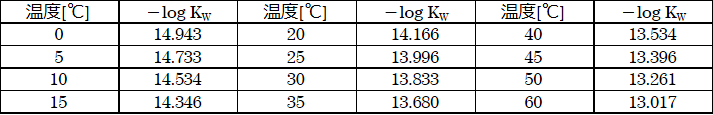
参考文献:A.W.Michalson;Chemical Engineering Process,64,67(1968)
数学的に表現すると、pHは次のように定義されます。
pH=-log [H+]=-log√Kw=-1/2 log Kw
ここで25℃のときのpHを表1と照らし合わせて計算すると、以下の式になります。
pH=-1/2×13.996=6.998≒7
つまり、pH値は「7」になるというわけです。
そもそも純水や超純水は、pHを酸性やアルカリ性に傾かせる物質を含んでいません。そのため、上記数式の結果からpH値が7になると導けるのです。
それでは、なぜ純水・超純水のpH測定は難しいのでしょうか。これは、超純水の導電率が極めて低いことに原因があります。以下に詳しく見ていきましょう。
正確なpH値を測定するには導電率が重要
pH測定法にはいくつかの方法がありますが、一般的に用いられる方法はガラス電極法です。
一般的に研究室で使用されるpH測定計では、100 μS/cm以上の導電率を持つ試料が必要とされます。ところが、超純水の導電率は0.055 μS/cmであり、pH測定に必要な導電率を有していません。このことから、ガラス電極法の測定対象外であることがわかります。
低導電率試料用の特殊な電極を用いたとしても、試料の正確なpHを測定するためには、試料の導電率は5 μS/cm以上が必要と言われています。やはり、純水や超純水では導電率の値があまりに小さく、pHを正しく測定することが困難なのです。
不純物を溶かしやすい超純水。空気との接触でpHは変化する
pHを正しく測定することが困難なほどに導電率が低いということは、純水や超純水は含まれる無機イオンが非常に少なく、空気中の不純物を溶かし込みやすい状態といえます。実際、超純水は物質を溶かしやすい性質があることから、別名ハングリーウォーターとも呼ばれます。そのため、採水後は空気中から二酸化炭素やイオン、揮発性の有機物などが超純水に溶解してしまいます。
例えば、pHを測定する際の空気の接触により、超純水は二酸化炭素を吸収し、時間の経過にともなって図1のようにpHが変化していきます。もちろん、空気から混入する物質は二酸化炭素だけではありません。アンモニアや実験室の環境によっては酸の蒸気なども考えられます。
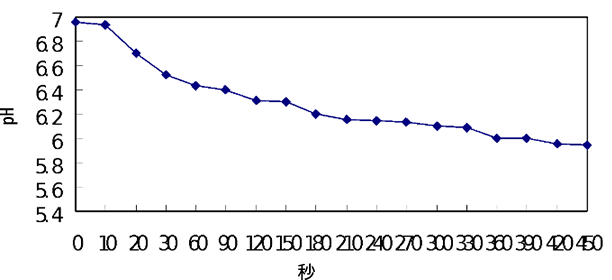
図1 空気中の二酸化炭素吸収に伴う超純水のpHの変化
参考文献:『pHを測る(化学セミナー13)』(佐藤弦・本橋亮一/丸善)
純水・超純水そのもののpH測定は非常に困難ですので、試薬調製のためにpH測定を行う場合には、試薬類を純水・超純水に溶解させた後に測定するとよいでしょう。そうすることで、十分な導電率が維持できます。
「超純水のpHを測定したら酸性だった。何か酸性の物質が残存しているのだろうか?」「装置に不具合があるのだろうか?」など実験中に疑問や不安を抱いたら、ぜひ「純水・超純水の導電率は低すぎて正しく測定するのは難しい」ということを思い出してみてください。
理論値に近い超純水のpH値を測定するには
原理的にpHの測定が困難な超純水ですが、可能な限り正確な測定をした時の結果を以下に示します。
まずは超純水が空気に触れると二酸化炭素が溶け込み、pHが酸性に傾いてしまうため、オーバーフローを行いながら測定を実施しました。
図2は、低導電率水測定用ガラス電極pHメーターを用いて、超純水のpHを3回測定した時の結果です。
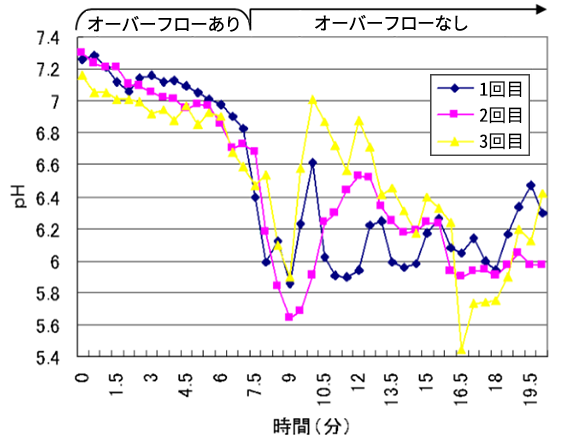
図2 超純水のpH測定例
測定開始時は超純水をゆっくりオーバーフローさせながら測定することにより、pH7前後の測定値が得られました。しかし、5分後にオーバーフローを止めたところ、測定値のバラつきが顕著になりました。原因としては導電率が十分ではないこと以外に、「炭酸の溶解による酸性側への傾き」や「ガラス電極内部標準液に用いられる塩化カリウムの溶出などによる影響」が考えられます。
このように、工夫をすれば理論値に近い超純水のpH値は測定可能であるものの、ぴったりpH7にはならない上に、その値を安定させることは困難であると分かりました。
pH測定だけじゃない!超純水の使い方の動画を無料視聴
今回ご紹介したpH測定以外にも、超純水の正しい使い方があります。
超純水の採水の仕方や使用時操作によって実験結果が変わることもありますので、この機会にぜひ動画でチェックしてみてください。
知って得する超純水を使用する上での10のコツをデータを交えてご紹介します!
動画視聴はこちらから
参照元
*1 厚生労働省. 水質基準項目と基準値
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/topics/bukyoku/kenkou/suido/kijun/kijunchi.html
*2 厚生労働省. 水質基準の見直しにおける検討概要 pH
https://www.mhlw.go.jp/topics/bukyoku/kenkou/suido/kijun/dl/k50.pdf
*3 厚生労働省. ミネラルウォーター類における化学物質等の成分規格の設定等について
https://www.mhlw.go.jp/stf/shingi/2r9852000000ypmm-att/2r9852000000ypq9.pdf
*4 堀場製作所. pH測定の方法
https://www.horiba.com/jpn/water-quality/support/electrochemistry/the-story-of-ph/ways-of-measuring-ph/
参考資料:堀場製作所『堀場pH計 Q&A集』
参考リンク:超純水装置・純水装置FAQ

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須