大腸菌発現タンパク質を可溶化する発現ベクター その種類と特徴

発現ベクターでタンパク質の可溶性を改善
大腸菌でタンパク質を発現させる際、タンパク質の正しいフォールディングが起こらず、封入体(インクルージョンボディー)になったり、活性のないタンパク質になったりする問題が生じます。これは、大腸菌の菌体内が動物細胞などと大きく異なり、極めて還元的な環境となっていることなどが要因です。
上記の問題を解決し、大腸菌で、タンパク質を正しくフォールディングさせ、可溶性を高めるためには主に3つの方法があります。
-
大腸菌内で可溶性の高いタンパク質と融合タンパク質として発現させる。(NusAなど)
-
還元環境を改善させるタンパク質と融合させて発現させる。(Trx、GSTなど)
-
分泌させて、中性環境に近いペリプラズム(大腸菌内外膜間の空間)に発現させる。(シグナル配列、Dsbなど)
これらを実現するpETベクターには以下の種類があります。
-
pET NusA Vectors:pET-43,1a-c(+) / pET-44,1a-c(+) / pET-50b(+)
-
pET Trx Vectors:pET-32a-c(+) / pET-48b-c(+)
-
pET GST Vectors:pET-41a-c(+) / pET-42a-c(+) / pET-49b(+)
-
pET Dsb Vectors:pET-39b(+) / pET-40b(+)
-
pET Signal Sequence Vectors:pET-20b(+) / pET-22b(+) / pET-25b(+) / pET-26b(+) / pET-27b(+)
今回は、それぞれの発現ベクターについて、その特徴と効果を紹介します。
発現ベクターの特徴と効果 pET NusA Vectors:pET-43,1a-c(+) / pET-44,1a-c(+) / pET-50b(+)
ポリペプチド配列を495アミノ酸のNusA(Nus•Tag)タンパク質と融合させ、高レベルな発現を行えるように設計された製品です。NusAタンパク質は、大腸菌データベース中の4,000以上のタンパク質を可溶性モデリングした結果、最も優れた可溶性ポテンシャルを有するとして同定されたTagです(Harrison 2000、Davis 1999)。4種類のNus•Tag融合タンパク質を用いた実験では、発現タンパク質の85%以上が可溶性になったと報告されています(Harrison 2000)。
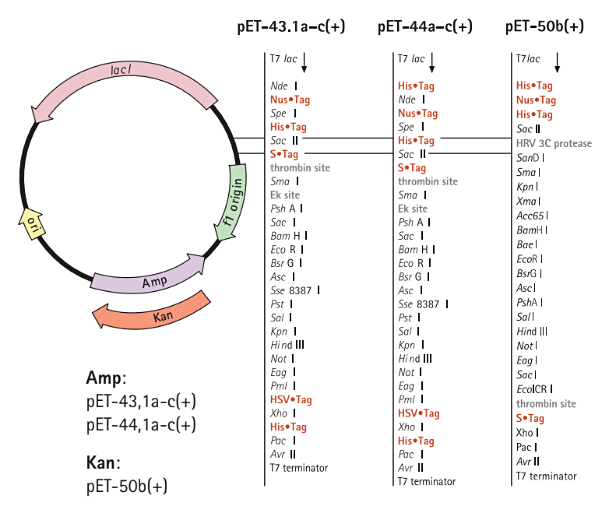
pET NusA Vectorsのベクターマップ
| 製品名 | カタログ番号 | 包装単位 |
|---|---|---|
| pET-43.1a(+) DNA | 70939-3 | 10 μg |
| pET-43.1b(+) DNA | 70940-3 | 10 μg |
| pET-43.1 Ek/LIC Vector Kit | 71072-3 | 20 rxn |
| pET-44a(+) DNA | 71122-3 | 10 μg |
| pET-44b(+) DNA | 71123-3 | 10 μg |
| pET-44c(+) DNA | 71124-3 | 10 μg |
| pET-50b(+) DNA | 71464-3 | 10 μg |
NovagenブランドのpET NusA Vectors関連製品(2019年10月時点)
以下の図は、Nus•Tag™融合が組換えアネキシンA1の溶解度を高めることを分析した結果です。図の1〜9のレーン・サンプルの番号は、次のように対応しています。
1 Perfect Protein™ Markers 10–225 kDa、2 Total cell protein(TCP)、3 Soluble fraction、4 Total cell protein(TCP)、5 Soluble fraction、6 Ni2+ His•Bind™ Fractogel eluate pool、7 Strep•Tactin® eluate pool、8 Thrombin digest、9 Post-thrombin His•Bind flowthrough。
アネキシンA1標的遺伝子を含むpENTR™ベクターが、Gateway®Nova pET-53-DEST™ベクター(レーン2〜3、pETHis•Tag™/アネキシンA1/Strep•Tag®II)とGateway Nova pET-57-DESTベクター(レーン4〜5、pET-His•Tag/Nus•Tag/トロンビン/アネキシンA1/Strep•Tag II)を用いて作製されました。可溶性アネキシンA1をHis•BindとStrep•Tactinカラムによって連続的に精製したものがレーン6〜7です。また、N末端融合タグをトロンビン切断とHis•Bindカラムにより除去したものがレーン8〜9になります。
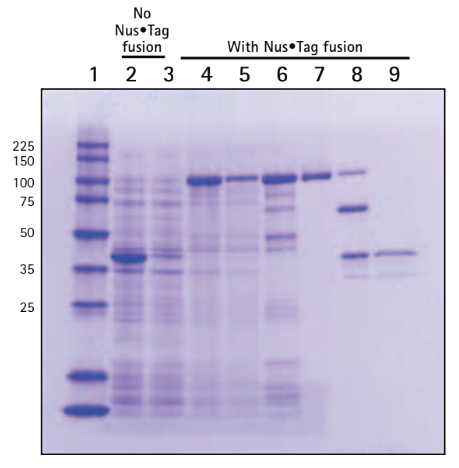
Nus•Tag融合は、組換えアネキシンA1の溶解度を高める
References:
Harrison, R.G. 2008. inNovations 29, 14.
Harrison, R.G. 2000. inNovations 11, 4.
Davis, G.D., et al. 1999. Biotechnol. Bioeng. 65, 382.
Novy, R. and Drott, D. 2002. inNovations 14, 12.
発現ベクターの特徴と効果 pET Trx Vectors:pET-32a-c(+) / pET-48b-c(+)
pET Trx Vectorsは109アミノ酸のTrx•Tag(チオレドキシンタンパク質)と融合させることによって、高レベルの発現を行うために設計された製品です。通常は大腸菌内で封入体として発現される多くのタンパク質も、Trx•Tagと融合させると可溶性が高まります(LaVallie 1993、Novy 1995)。また、pET-32ベクター、pET-48ベクターはtrxB/gor変異体のOrigamiシリーズ(Origami 2、Origami B)およびRosetta-gamiシリーズ(Rosetta-gami、Rosetta-gami 2)と共に使用可能です。
チオレドキシンリダクターゼ(trxB)変異は、大腸菌細胞質内におけるジスルフィド結合の形成を促進することが示されています(Derman 1993)。pET-32およびpET-48ベクターから発現されるチオレドキシン融合タグは、多くの目的タンパク質の可溶性を高めるだけでなく、trxB変異体の細胞質内におけるジスルフィド結合の形成を促します(Stewart 1998)。
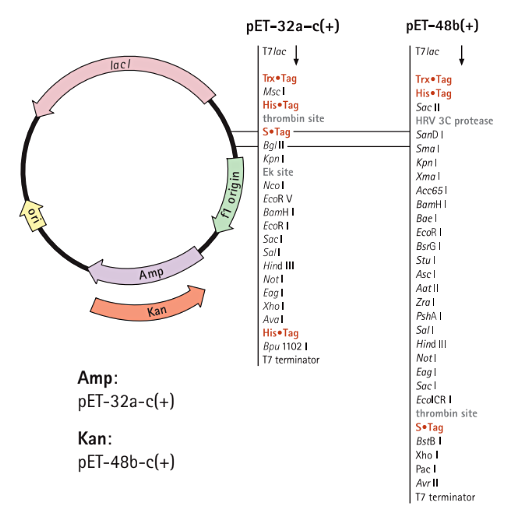
pET Trx Vectorsのベクターマップ
| 製品名 | カタログ番号 | 包装単位 |
|---|---|---|
| pET-32a(+) DNA | 69015-3 | 10 μg |
| pET-32b(+) DNA | 69016-3 | 10 μg |
| pET-32c(+) DNA | 69017-3 | 10 μg |
| pET-32 Ek/LICVector Kit | 69076-3 | 20 rxn |
| pET-32 Xa/LICVector Kit | 70072-3 | 20 rxn |
| pET-48b(+) DNA | 71462-3 | 10 μg |
NovagenブランドのpET Trx Vectors関連製品(2019年10月時点)
また、OrigamiシリーズおよびRosetta-gamiシリーズホストには、細胞質ジスルフィド代謝のもうひとつの中心的酵素であるグルタチオンリダクターゼ(gor)遺伝子にもさらに変異が加えられています。そのため、これらの株は大腸菌細胞質内におけるジスルフィド結合形成をさらに高いレベルで促進します(Prinz 1997)。pET-32およびpET-48コンストラクトをtrxB/gor変異体ホストで発現させることで、可溶かつ活性をもち正しく折り畳まれた目的タンパク質を最も効率よく回収できる可能性がさらに高くなります。
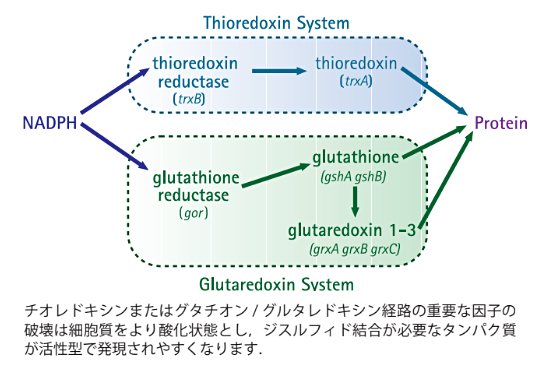
タンパク質の発現とチオレドキシン経路、グルタチオン/グルタレドキシン経路
以下の図は15℃、25℃、37℃で誘導されたpET-32a(+)IL-2クローンの分析結果です。示されている組換え体は、BL21(DE3)で産生され、IPTGによって標的タンパク質の発現を誘導し、可溶性
ゲルAとゲルBのレーンは、それぞれ、同じ培養液中の可溶性および不溶性画分に対応します。誘導温度は温度は図中に示されている通りです。NIL2はpET-32a(+)のNco I/Bpu 1102 IサイトでクローニングされたIL-2、XIL2はpET-32a(+)のXho I/Bpu 1102 IサイトでクローニングされたIL-2を指します。
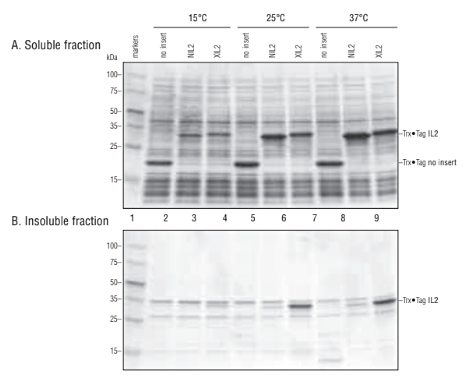
15℃、25℃、37℃で誘導されたpET-32a(+)IL-2クローンの分析
References:
LaVallie, E.R., et al. 1993. Biotechnology 11, 187.
Novy, R., 1995. inNovations 3, 7.
Derman, A.I., 1993. Science 262, 1744.
Stewart E.J., et al. 1998. EMBO J. 17, 5543.
Prinz, W.A., et al. 1997. J. Biol. Chem. 272, 15661.
発現ベクターの特徴と効果 pET GST Vectors:pET-41a-c(+) / pET-42a-c(+) / pET-49b(+)
融合タグとしてグルタチオン-S-トランスフェラーゼ(GST; GST•Tag)が組込まれています。このGST•Tagは、その融合タンパク質の合成を強化し、また場合によっては、可溶性も高めることが報告されています(Smith 1988)。可溶性で正しく折り畳まれて発現したGST•Tag融合タンパク質は、固定したグルタチオンを用いて精製可能です。そして、還元グルタチオンを含むバッファーを用いて、穏やかな溶出を行うことができます。また、可溶なGST融合タンパク質の定量は、トランスフェラーゼ活性の測定によって行えます。
他の市販のGST融合ベクターとは対照的に、Factor Xa(IleGluGlyArg、pET-42シリーズ)およびエンテロキナーゼ(AspAspAspAspLys、pET-41シリーズ)のタンパク質切断部位は、ベクターに由来する配列を100%完全に除去し、もともとのN末端残基をもつ目的タンパク質を生成できるように設計されています。
pET GST Vectorsのベクターマップ
| 製品名 | カタログ番号 | 包装単位 |
|---|---|---|
| pET-41a(+) DNA | 70556-3 | 10 μg |
| pET-41b(+) DNA | 70557-3 | 10 μg |
| pET-41 Ek/LICVector Kit | 71071-3 | 20 rxn |
| pET-42a(+) DNA | 70561-3 | 10 μg |
| pET-42b(+) DNA | 70562-3 | 10 μg |
| pET-49b(+) DNA | 71463-3 | 10 μg |
NovagenブランドのpET GST Vectors関連製品(2019年10月時点)
References:
Smith, D.B. and Johnson, K.S. 1988. Gene 67, 31.
発現ベクターの特徴と効果 pET Dsb Vectors:pET-39b(+) / pET-40b(+)
ペプチド配列に208アミノ酸のDsbA•Tag[pET-39b(+)]または236アミノ酸のDsbC•Tag[pET-40b(+)]を融合させ、高レベルな発現を行うために設計された製品です。DsbAとDsbCはそれぞれ、ジスルフィド結合の形成と異性化を触媒するペリプラズム酵素です(Rietsch 1996、Sone 1997、Missiakas 1994、Zapun 1995、Raina 1997)。細胞質中での可溶性を高めるよう設計されたpET-32 Trx•Tagシリーズとは異なり、このDsbA•TagおよびDsbC•Tagベクターはペリプラズムへの局在化を促進します。ペリプラズムの非還元環境中では可溶性が向上し、適切な折り畳みが促進されます(Collins-Racie 1995)。
pET Dsb Vectorsのベクターマップ
| 製品名 | カタログ番号 | 包装単位 |
|---|---|---|
| pET-39b(+) DNA | 70090-3 | 10 μg |
| pET-40b(+) DNA | 70091-3 | 10 μg |
NovagenブランドのpET Dsb Vectors関連製品(2019年10月時点)
References:
Rietsch, A., et al. 1996. Proc. Natl. Acad. Sci. USA 93, 13048.
Sone, M., et al. 1997. J. Biol. Chem. 272, 10349.
Missiakas, D., et al. 1994. EMBO J. 13, 2013.
Zapun, A., et al. 1995. Biochemistry 34, 5075.
Raina, S. and Missiakas, D. 1997. Ann. Rev. Microbiol. 51, 179.
Collins-Racie, L.A., et al. 1995. Biotechnology 13, 982.
発現ベクターの特徴と効果 pET Signal Sequence Vectors:pET-20b(+) / pET-22b(+) / pET-25b(+) / pET-26b(+) / pET-27b(+)
目的タンパク質にペリプラズムへの輸送を促進するシグナル配列(ペリプラズムへ移行させるためのpelBシグナルシークエンス)を融合するよう設計されたベクターです。ペリプラズムは非還元的でフォールディングに適した環境であり、ジスルフィド結合の形成を促進することから、ある種の目的タンパク質では可溶性と活性が高まります。通常、シグナル配列は輸送に伴って、シグナルペプチダーゼにより切断されます。
pET Signal Sequence Vectorsのベクターマップ
| 製品名 | カタログ番号 | 包装単位 |
|---|---|---|
| pET-20b(+) DNA | 69739-3 | 10 μg |
| pET Expression System 22b | 70765-3 | 1 system |
| pET-22b(+) DNA | 69744-3 | 10 μg |
| pET-25b(+) DNA | 69753-3 | 10 μg |
| pET-26b(+) DNA | 69862-3 | 10 μg |
| pET-27b(+) DNA | 69863-3 | 10 μg |
NovagenブランドのpET Signal Sequence Vectors関連製品(2019年10月時点)
以上、タンパク質を正しくフォールディングさせ、可溶性を高めるベクターについて紹介しました。これらの問題解決には、ベクター選択、ホスト選択両方からのアプローチが可能です。目的や状況に合わせて適切なものを選択し、試してみると良いでしょう。
(編集註)
データや解説は2009年1月当時のものです。一部の製品は2019年10月時点で販売停止となっております。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




