Nus•Tagによる大腸菌発現タンパク質の可溶化

Nus•Tagシステムの魅力
大腸菌の菌体内は動物細胞などと大きく異なり、極めて還元的な環境となっています。そのため大腸菌でタンパク質を発現させる際、S-S結合などを必要とするタンパク質の正しいフォールディングが起こらないなどの現象が多く見られ、封入体(インクルージョンボディー)になってしまったり、活性のないタンパク質になってしまったりといった問題が生じます。
このような問題を解決し、発現タンパク質の可溶性を向上させるための工夫の一つに、目的タンパク質を大腸菌内で可溶性の高いタンパク質との融合タンパク質として発現させるという方法があります。この記事ではその一例として、NusAタンパク質を融合させ、可溶性を促進させるNus•Tagシステムについて紹介します。
NusAタンパク質は転写終結関連因子として見出されたタンパク質で(Davis 1999年)、495アミノ酸からなります(55 kDa、SDS-PAGEでは69 k位置)。1999年に報告され、2000年にはNovagen®によりpET NusA Fusion System(Nus•Tag)として初めて製品化されました。
このシステムはNusAタンパク質の可溶性促進作用、すなわち、大腸菌内で単独発現させると不溶性だった標的タンパク質のアミノ末端に、NusAタンパク質を融合させると可溶性が促進されるという報告に基づいています。販売開始以来、Nus•Tagは様々なハイスループット発現ススクリーニング系で採用されています。プロテアーゼによってNus•Tagを切断除去した後に、活性を保持したタンパク質を得ることに成功したという報告が多数あり、さらにNus•Tagと融合した状態で活性を保持するタンパク質の報告もあります。現在、Nus•Tagは大腸菌発現系で広く使用されている融合タグの1つです(Cabrita 2006年)。Nus•Tagによる可溶性促進機構についても研究されています。
Nus•Tag融合タンパク質の可溶性評価
大腸菌組み換えタンパク質発現系におけるNus•Tag融合タンパク質の可溶性を検討した論文報告から、幅広い分子量の異種標的タンパク質を多数用いた3つの実験結果を表1にまとめました。
Shihらが実施した実験(2002年)の注目すべき点は、様々な生物種の標的タンパク質を用いた点です。
Korfらが実施した実験(2005年)では、Nus•Tagの可溶性は、30°Cで誘導した場合よりも20°Cで誘導した場合において高い結果が得られています。さらに、8種類の分子量の大きい(70 kDaを超える)タンパク質を様々な融合タグに結合させ可溶性について比較したところ、発現誘導された可溶性タンパク質は、Nus•Tagを用いた場合は7種類であったのに対し、他の融合タグ3種類(GST、MBP、6×His)を用いた場合は4種類だったとの報告もあります。
Korfらによる他の所見として、通常は真核細胞の細胞内小器官、細胞膜、細胞骨格に存在するタンパク質では、Nus•Tagを選択した場合、他の融合タグと比較してもっとも可溶性が向上すると述べています。
また、Kohlら(2008年)によると、タンパク質発現を20〜25℃で誘導する場合、膜タンパク質などの可溶化が困難なタンパク質の可溶性促進に、Nus•Tagが有用であると述ベています。Korfらの所見と同じく、Kohlらは、25℃でタンパク質発現を誘導した場合、30℃または37℃でタンパク質発現を誘導した場合と比較して、Nus•Tag融合タンパク質の収量が増える可能性を示唆しています。
表1.多種多様なタンパク質をNus•Tag融合タンパク質として発現させた際の可溶性評価

Nus•Tagを除去しても活性や正しい折り畳み構造を維持するタンパク質
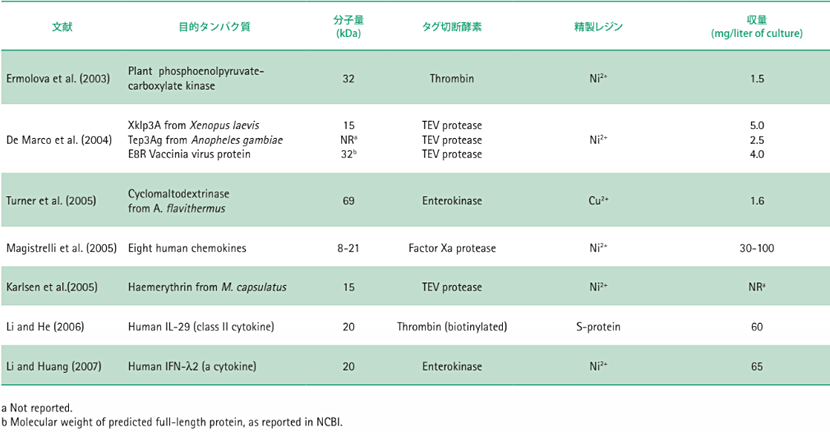
Nus•Tag融合タンパク質として発現させNus•Tagを切断除去した後も、活性を保持するタンパク質、もしくは正しい折り畳み構造を維持する標的タンパク質に関するいくつかの研究データを表2にまとめました。実験には主に分子量20 kDa以下の標的タンパク質が用いられています。標的タンパク質の収量は、培養液1 Lあたり1.5〜100 mgの範囲で、ケモカインおよびサイトカインに関しては、30〜100 mg/Lという高い収量が得られています。また、各タンパク質の発現および精製に関して、以下のような興味深い追加情報があります。
植物由来9ホスホエノールピルビン酸-カルボン酸キナーゼ(Ermolova 2003年)
BDA(ブルーデキストラン・アガロース)色素アフィニティカラムを用い、タグ切断後の標的タンパク質をさらに精製しました。タグ切断後の標的タンパク質では、タグ切断前と比較して50倍高い触媒効率が得られました。
Xklp3a、Tep3Ag、E8R(De Marco 2004年)
タグ切断後、Hisタグ融合TEVプロテアーゼ及びHisタグ融合Nus•TagをNi2+カラムを用いて選択的に除去し、アフィニティタグと樹脂を強く結合させたまま、標的タンパク質を未結合画分に回収しました。標的タンパク質3種類は、いずれも精製後に正しく折りたたまれていました。細胞膜結合E8Rワクシニアウイルスタンパク質を精製し、Nus•Tagを除去したところ、Tris緩衝液中で不溶性になり沈殿しました。しかし、0.02%ドデシルマルトシドおよび150 mmol/L塩化ナトリウムを添加することにより、Nus•Tag除去後もE8Rタンパク質は可溶性になりました。
シクロマルトデキストリナーゼ(Turner 2005年)
シクロマルトデキストリナーゼはα-アミラーゼタンパク質ファミリーのひとつです。このファミリーに属するタンパク質は、大腸菌内で活性型として発現させることが困難な事が知られています。シクロマルトデキストリナーゼをNus•Tag融合タンパク質として発現させ、エンテロキナーゼ(カタログ番号 69066-3)を用いてNus•Tagを切断した結果、Nus•Tagを切断していない融合タンパク質と比較して2倍の活性レベルに達しました。この結果から、タンパク質融合によって酵素活性が減少することがわかりました。
ヒト由来ケモカイン(Magistrelli 2005年)
すべての標的タンパク質をNovagen OrigamiTM B株内で発現させ、ケモカインをコードする配列のC末端にAviTagTM(アビディティー)ビオチン化部位の配列を導入しました。単量体アビジン樹脂を用いたアフィニティクロマトグラフィによって精製後、Nus•Tagを切断、精製しました。Nus•Tag融合タンパク質はいずれも活性を示しませんでしたが、タグ切断、精製したタンパク質は活性を示しました。
ヘムエリトリン(Karlsen 2005年)
Nus•Tagを切断した後、ヘムエリトリンをゲルろ過クロマトグラフィーによってさらに精製しました。精製ヘムエリトリンを円偏光二色性によって測定した結果α-ヘリックス構造含量は、モデリングによって予測したα-ヘリックス構造含量とほぼ一致しました。また精製タンパク質は、単量体で安定でした。
ヒト由来IL-29(Li 2006年)
Ni2+カラム用いたHis•Tagアフィニティー精製と比較して、S•Tagアフィニティー精製を用いた方が、高純度の融合タンパク質が得られました。アミノ末端NusA/His•TagTM/S•TagTM融合タンパク質をビオチン化トロンビン(カタログ番号 69672-3)を用いて切断した後、ストレプトアビジン・アガロース(カタログ番号 69203-3)を用いて残存ビオチン化トロンビンを除去しました。ヒト不死化羊膜上皮細胞系(WISH細胞)に感染させた疱性口内炎ウイルス(VSV)に対して精製IL-29の抗ウイルス活性が観察されました。
ヒト由来IFN-λ2(Li 2007年)
Nus•Tagを組換え型エンテロキナーゼ(カタログ番号 69066-3)で切断した後、残存エンテロキナーゼをNovagen EKaptureTM Agarose(カタログ番号 69068)を用いて除去しました。ヒト不死化羊膜上皮細胞系(WISH細胞)への疱性口内炎ウイルス(VSV)感染24時間前に添加した場合、精製IFN-λ2はウイルス誘発変性作用からのWISH細胞保護能を示しました。
表2.Nus•Tagを切断除去しても活性を保持するタンパク質、正しい折り畳み構造を維持するタンパク質
活性を保持したNus•Tag融合タンパク質
Nus•Tag融合タンパク質からNus•Tagを切断、除去し、活性型タンパク質を精製している報告が多数ありますが、Nus•Tagと融合した状態でも、標的タンパク質が活性を保持しているとの報告も多数あります。そのようなNus•Tag融合タンパク質として以下が挙げられます。
- ScFv触媒抗体14D9(Zheng 2003年)
- オワンクラゲAequorea victoria由来の緑色蛍光タンパク質(Nallamsetty 2006年)
- ヒト由来のジヒドロ葉酸還元酵素(Nallamsetty 2006年)
- マテガイEnsis directus由来のアルギナーゼキナーゼ(Compaan 2003年)
- B. thuringiensis由来の修飾δエンドトキシン(Kumar 2005年)
- ヒト由来のBCMA膜貫通型受容体(Guan 2006年)
- 植物由来のα-ジオキシゲナーゼ1(Liu 2006年)
- および熱帯熱マラリア原虫Plasmodium falciparum由来のβ-ケトアシル-アシル担体タンパク質合成酵素(Lack 2006年) など
Nus•Tagの可溶性促進機構
NusAタンパク質は、in vivoでシャペロニンGroELの必須基質となることがわかっています(Houry 1999年)。GroEL(および補因子GroES)は、あらゆる大腸菌増殖条件下で必須となる唯一のシャペロン系です。Douetteら(2005年)は、可溶型Nus•Tag-UCP1(非共役タンパク質1:ミトコンドリア膜タンパク質)融合タンパク質の発現量について検討しました。その結果、16°CでGroELの共過剰発現に反応し、可溶性が増加しました。この結果は、NusAタンパク質がパートナータンパク質の凝集を抑制し、シャペロン経路と相互作用することを示唆しています。
以上、Nus•Tagシステムによる発現タンパク質の可溶化について紹介しました。この他にもタンパク質を正常にフォールディングさせ、可溶化させるための様々な手法や工夫が存在します。目的タンパク質や実験系にあった方法を探して試してみるとよいでしょう。
References
Cabrita, L.D., et al. 2006. BMC Biotechnol. 6, 12.
Compaan, D.M. and Ellington, W.R. 2003. J Exp. Biol. 206, 1545. Davis, G.D., et al. 1999. Biotechnol. Bioeng. 65, 382.
De Marco, V., et al. 2004. Biochem. Biophys. Res. Commun. 322, 766. Douette, P., et al. 2005. Biochem. Biophys. Res. Commun. 333, 686. Ermolova, N.V., et al. 2003. Protein Expr. Purif. 29, 123.
Guan, Z.B., et al. 2006. Sheng Wu Gong Cheng Xue Bao 22, 46. Houry, W.A., et al. 1999. Nature 402, 147.
Karlsen, O.A., et al. 2005. FEBS J 272, 2428.
Kohl, T., et al. 2008. Proteome Sci. 6, 4.
Korf, U., et al. 2005. Proteomics 5, 3571.
Kumar, S., et al. 2005. J Inverteb. Pathol. 88, 83.
Lack, G., et al. 2006. J Biol. Chem. 281, 9538.
Li, M. and He, S. 2006. J Biotechnol. 122, 334.
Li, M. and Huang, D. 2007. Biotechnol. Lett. 29, 1025.
Liu, W., et al. 2006. Plant Physiol. Biochem. 44, 284.
Magistrelli, G., et al. 2005. Biochem. Biophys. Res. Commun. 334, 370. Nallamsetty, S. and Waugh, D.S. 2006. Prot. Expr. Purif. 45, 175.
Shih, Y.P., et al. 2002. Protein Sci. 11, 1714.
Turner, P., et al. 2005. Prot. Expr. Purif. 39, 54.
WilkInson, D.L and Harrison, R.G. 1991. Biotechnol. (N.Y.). 9, 443. Zheng, L., et al. 2003. J Biochem. 133, 577.

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須