タンパク質精製処理の時間短縮!Amicon Pro精製システムのすべて

タンパク質の精製処理を1つのデバイスに集約
タンパク質の構造や機能を解析するためには、高純度で高活性のタンパク質を確実に回収することが重要です。そのためタンパク質の精製に多くの時間を費やすことになります。この問題を解決するのがメルクのAmicon Pro精製システムです。
Amicon Pro精製システムは、アフィニティー精製用のスピンカラムと精製後のサンプル濃縮、バッファー交換用の限外ろ過ユニットがセットになったデバイスです。タンパク質精製の全ステップを単一のデバイス中で処理することが可能で、タンパク質の前処理ワークフローを一体化できます。これにより、何度もサンプルを移動させる必要がなくなり、タンパク質の損失を最小限に抑え時間も短縮できる便利な製品です。
この記事では、Amicon Pro精製システムのワークフローと、メリットについて検証した実験の結果を紹介します。
Amicon Pro精製システムのワークフロー
Amicon Pro精製システムではさまざまなサンプル容量に適応可能な大型の回収チューブを使用します。これにより、1回の遠心で溶出と濃縮および高効率(>99%)の透析が同時に実行可能になりました。
図1にAmicon Pro精製システムのワークフローを示します。
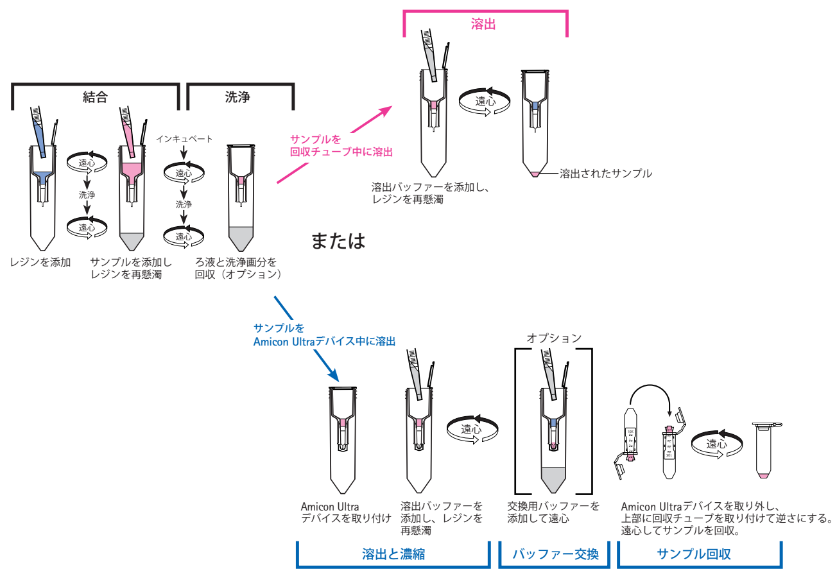
図1. Amicon Pro精製システムのワークフロー
Amicon Pro 0.5 mL遠心フィルターを用いたAmicon Pro精製システムによるタンパク質のアフィニティー精製では2種類のプロトコールを選択できます。
充填するレジンが200 μL を超える場合、タンパク質量がAmicon Ultra 0.5 mLデバイスの保持力を越えるため、濃縮までのステップを同時に行うことは推奨できません。タンパク質精製プロトコールは、結合、洗浄および溶出に限定されます(図1の上段)。
充填するレジンが200 μL 以下の場合、Amicon Ultra 0.5 mLデバイスを取り付けることができ、溶出ステップ中に同時に濃縮することが可能です(図1の下段)。オプションとしてバッファー交換ステップ(遠心式)も実施できます。最終サンプルは逆遠心によりAmicon Ultra 0.5 mLから回収します。
Amicon Pro精製システムの5つのメリット
それではAmicon pro精製システムと通常法を比較してみましょう。Amicon Pro精製システムには通常法に比べて5つのメリットがあります。これらのメリットを、検証結果を参照しながら紹介します。
-
実験時間を短縮できる
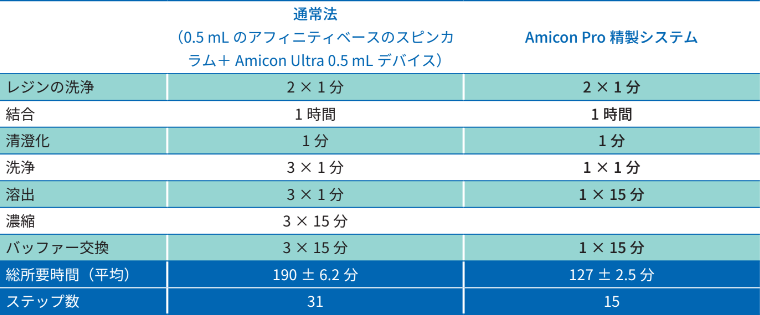
Amicon Pro精製システムを用いると実験時間を短縮できます。表1に、Amicon Pro精製システムと通常のAmicon Ultra 0.5 mLを用いたアフィニティベースのスピンカラムのワークフローの比較結果を示しました。

表1. Amicon Proと通常法のワークフローの比較
表1からわかるように、Amicon Proデバイスを用いることで、通常3回行う洗浄、溶出、濃縮およびバッファー交換時のステップが1回で済み、全体のステップ数が31から15に減少しました。これにより、総所要時間の平均が約1時間も短縮しました。
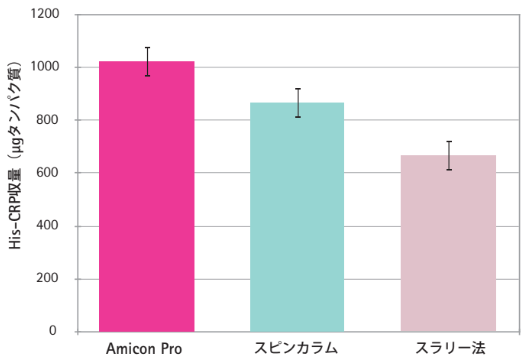
次に、サンプルの収率や精製度について見てみましょう。図2はE. coli 細胞溶解液0.5 mLから精製したHis-CRPの収量の比較結果を示しています。同一の開始パラメータ(レジン、細胞溶解液および結合時間)で、Amicon Proデバイスは0.5 mLスピンカラムと比べて収率が18%高く、バッチスラリー法と比較すると53%も多い収量を得ることができました。

図2. E. coli 細胞溶解液0.5 mLから精製したHis-CRPの収量の比較
-
高効率の洗浄ステップが可能
Amicon Proデバイスの上部には10 mLの保持力がある大容量チャンバーがセットされています。このユニークな構造設計が洗浄効率を大幅に改善します。
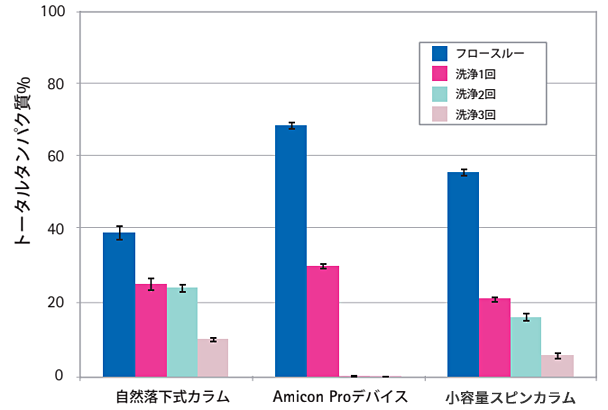
図3は遠心洗浄で除去できた非特異的タンパク質量を示しています。

図3. 遠心洗浄で除去できたトータルタンパク質量の比較
図3からわかるように、Amicon Proデバイスは1回の洗浄ステップでほぼすべての標的タンパク質を除去できました。一方、小容量のアフィニティベースのスピンカラムや自然落下式カラムに基づく方法では、3回の洗浄が必要でした。
-
希釈なしで溶出できる
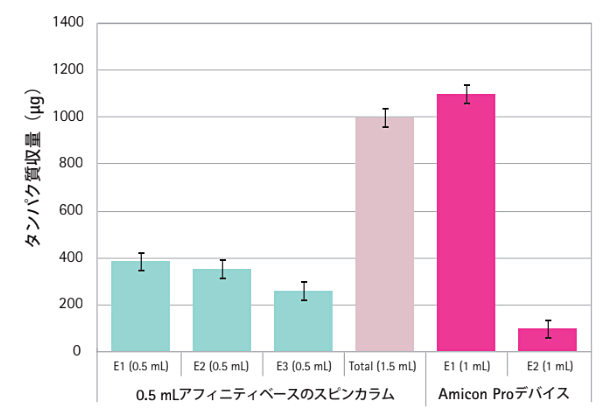
大容量チャンバーは洗浄だけでなく溶出ステップにおいても利点となります。図4に、サンプルの希釈なしでタンパク質を溶出した結果を示しました。

図4. サンプル希釈なしでのタンパク質の溶出
この実験では、まずNi-NTAアガロースレジン100 μLおよびHis-CRP細胞溶解液0.5 mLをAmicon Proまたは通常のデバイスに添加し、インキュベートを行いました。続いてフロースルーの除去および洗浄の後、溶出バッファー1.5 mLを1回(Amicon Pro)または溶出バッファー500 μLを3回(小容量スピンカラム)行い、遠心デバイスからタンパク質を溶出しました。
その結果、小容量のスピンカラムでは3回の溶出ステップが必要でしたが、Amicon Proデバイスでは1回の1分間遠心でアフィニティー精製されたタンパク質の90%以上を回収することができました。
-
広範囲にわたるサンプル容量の処理が可能
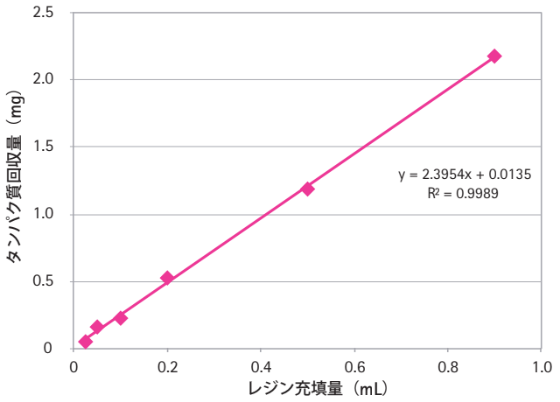
Amicon Proデバイスの大容量交換チャンバーは、広範囲にわたるサンプル容量の処理を可能にします。様々なサンプル容量(レジン充填量)についてタンパク質回収量を調べた結果を図5に示しました。

図5. Amicon Proデバイスを用いた精製におけるレジン充填量に対するトータルタンパク質収量
サンプル容量の増加に伴いタンパク質回収量が直線的に増加することから、広範囲のサンプル容量において良好なタンパク質回収量を得られることがわかります。
-
高いサンプル活性を保つ
Amicon Proデバイスの交換デバイスのチップ部分は、Amicon Ultra 0.5 mLフィルターの構造にぴったりフィットするように設計されています。この構造により、フィルトレーション機能を持つ膜表面積が増加し、プラスチックの側壁間の空間が減少します。これにより、バッファー交換能力が最大化され、1回の遠心で新たなバッファーを十分に撹拌できるのです。
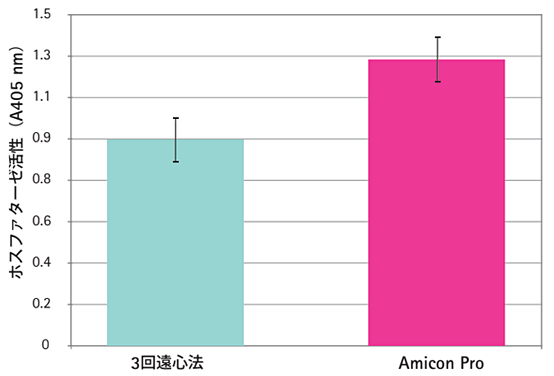
限外ろ過膜を用いた脱塩やバッファー交換をダイアフィルトレーションと呼びます。Amicon Proデバイスのダイアフィルトレーションの性能を評価するために、GST-LPP(ラムダタンパク質ホスファターゼ)の溶出サンプルを、Amicon Proデバイス(バッファー1.5 mLを用いた15分間の遠心1回)またはAmicon Ultra 0.5 mLデバイス(バッファー各0.5 mL を用いた15分間の遠心3回)を用いてバッファー交換を行いました。その後、得られた画分のホスファターゼ活性を測定しました。
この結果を図6に示します。

図6. Amicon Ultra 0.5 mLデバイスおよび Amicon Proデバイスを用いたバッファー交換後のGST-LPP画分のホスファターゼ活性
Amicon Proで調製したGST-LPP画分は、3回の遠心法を用いた場合と比較して、高い活性を維持していました。この検証から、Amicon Proデバイスを用いたタンパク質精製では、サンプルの活性も比較的高く保たれることがわかりました。
以上、5つの比較解析から、Amicon Proデバイスを用いたタンパク質の精製には多くのメリットがあることが示されました。効率的かつ簡便にタンパク質精製を行いたい人は、ぜひAmicon Proデバイスの使用を検討してみてください。
参考文献
1. Merck Millipore, Amicon Pro User Guide, Literature Number PR04105, Rev. A, March 2013.
2. Merck Millipore, Amicon Pro Affinity Concentration Kit Ni-NTA User Guide, Literature Number BWENT Rev. B, February 2013.

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須