血球計算盤を用いた生細胞数の数え方

染色によって細胞形態を可視化する
トランスフェクションや細胞融合技術、凍結保存など、細胞培養操作の多くは、操作の前に細胞をカウントする必要があります。この記事では血球計算盤を用いた生細胞数の数え方について解説します。
ここで紹介するトリパンブルーは、生細胞数を決定するための色素排除試験において使用が推奨されている染色剤の一種です。この方法は「生細胞(生存能力のある細胞)は特定の色素を取り込まないが死細胞(生存能力のない細胞)はその色素を取り込む」という原理に基づいています。この染色によって、細胞形態の可視化が容易となります。
こうした手法によって生細胞数を正確に測定し、適切な細胞数に調整することで、培養環境を最適な条件にし、良好な再現性を得ることができます。
まずはおおまかな流れを確認しましょう。
- 細胞を集める
- 新しい培地に再懸濁する
- 細胞懸濁液から100〜200 µL採取する
- トリパンブルーを加える
- 血球計算盤(ヘモサイトメーター)とカバーガラスの準備
- 細胞をカウントする
- 細胞密度を計算する
必要な機器、試薬は下記の通りです。
- 37℃に温めた培地(または細胞に添付されたECACC Cell Line Data Sheetに推奨された温度)
- 70%エタノール
- トリパンブルー溶液
- インキュベーター
- 培養容器とラベル
- 倒立顕微鏡、位相差顕微鏡
- 遠心分離機
- 血球計算盤(ヘモサイトメーター)
- マーカーペン
- 駒込ピペット
- バイアルを立てるラック
生細胞数の測定手順
以下に、具体的な測定手順を説明していきます。
- 新しい培地に再懸濁する
接着性細胞(半接着を含む)はトリプシン-EDTAを使用し、懸濁液の状態にします。懸濁液には、トリプシンと等量以上の培地を加えます。細胞塊になっているものは遠心後ピペッティングして塊を崩し単一細胞にしましょう。
- 細胞懸濁液から100〜200 µL採取する
細胞懸濁液から100〜200 µLを試験管に入れます。
- トリパンブルーを加える
トリパンブルーを等量加え(希釈係数=2)、十分にピペッティングし混合液にします。
- 血球計算盤(ヘモサイトメーター)とカバーガラスの準備
血球計算盤を水で洗い、キムワイプなどで水気を除いて清潔にします。血球計算盤にカバーガラスを載せ、指ですり合わせるようにしながら、カバーガラスを割らない程度に軽く力を入れて密着させます。密着した部分にニュートンリング(丸い虹のようなリング)が現れます。
- 細胞をカウントする
細胞混合液をよく懸濁し、細胞が沈まないうちにピペットで吸い取ります。カバーガラスと計算盤の密着した隙間部分に試料(混合液)を5〜10 µL(あふれない程度)注入し、倒立顕微鏡の低倍率で計測します。
1 mm × 1 mmの区画内の全細胞数と染色された細胞数を分けて計数します。色のついていない明るい細胞は生細胞で、染色されているのは死細胞です。1 mm角の枠内におよそ100個の細胞があるように濃度を調節します。濃すぎるとカウントしづらく、また薄すぎると不正確になるので注意しましょう。
標準的な血球計算版のチャンバー
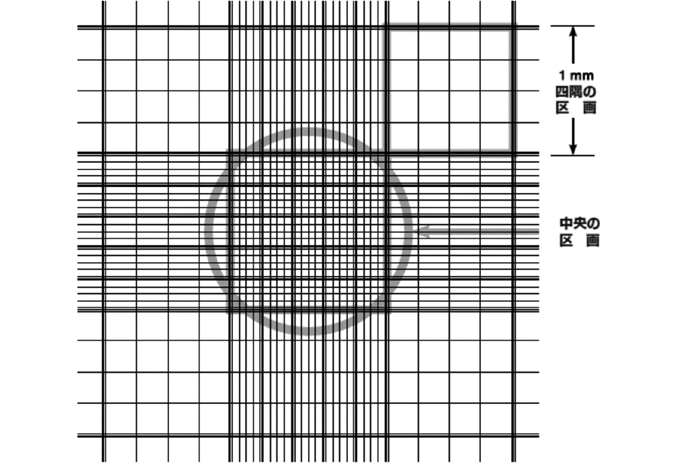
標準的な血球計算盤のチャンバーは、上図のように区切られています。左上のチャンバー1から計数を始め、中央の1 mm2区画内と四隅の1 mm2区画内の全細胞を数えます。青色に染色された死細胞と、染色されていない生細胞とを別々に数えましょう。
四隅の区画(拡大)
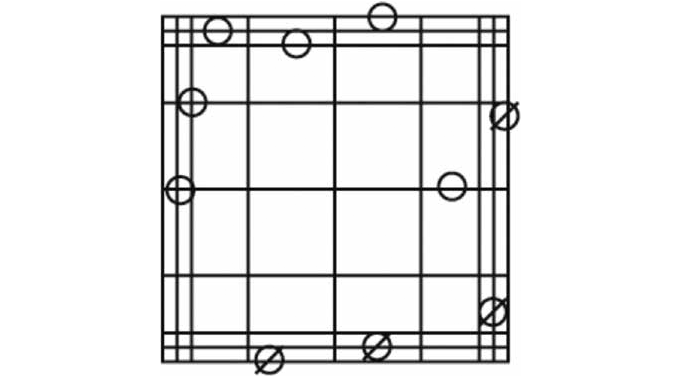
各区画の境界の中央線に触れている細胞のうち、上側と左側にあるもの(O)は数えますが、下側と右側にあるもの(∅)は数えません。
チャンバー内の中心区画の面積は1 mm2です。標準的な血球計算盤の目盛りは中心区画内が25区画に分かれています(1区画あたり1/25 mm2)。四隅の小さな区画は三重線で区切られており、さらにその中は16 区画に分かれています。チャンバーの深さは0.1 mmです。したがって各区画は0.1 mm3、すなわち10-4 cm3 に相当します。
<計算方法>
以下の計算式を使って細胞の生存率を求めます。
生細胞数=(区画中の全生細胞 / 数えた区画数)×希釈倍率 × 10,000
死細胞数=(区画中の全死細胞 / 数えた区画数)×希釈倍率 × 10,000
細胞生存率(%)=生細胞数 / 全細胞(生細胞 + 死細胞) × 100
測定時のポイント
トリパンブルーは毒性が強く発ガン性があります。扱う際にはラボ手袋、白衣、ゴーグルなどを着用しましょう。また蒸気を吸い込まないよう気をつけましょう。
血球計算盤とカバーグラスの間に試料を流し込むときは、毛細現象で計算盤に吸い込まれるようにゆっくりと行います。
次のような要因によってカウントが不確実になってしまうことがあるので注意しましょう。
- チャンバー内に余分な空気やホコリが入っている
- チャンバー内に過剰な試料が入り、他の区域と混ざってしまう
- チャンバー内の試料が足りない
- 細胞が均一にチャンバー内に位置していない。
- 細胞数が少なすぎてカウントできない。(この場合は再懸濁させて再度カウントすることによって解消される場合があります。)
- 細胞数が多すぎてカウントできない。(この場合はトリパンブルーによる希釈を薄くする(希釈係数 = 10 など)事により解消されることがあります。)
血球計算盤を使う手法は行う人と細胞系によっては時間がかかる場合があります。特にクラスター化する細胞系などをこの方法で計測する人には熟練度が必要となります。そのような場合にはセルアナライザーなどの細胞解析機器なども利用するとよいでしょう。
以上、血球計算盤を用いた生細胞数の数え方について解説しました。生細胞数を正確にカウントすることは、培養条件を適切な状態に整え、実験の再現性を確保するために必要なテクニックです。しっかりマスターしましょう。
<無料PDFダウンロード> 細胞培養ガイド
~ヒトやマウス・ラット細胞、ES/iPS細胞まで~
このガイドブックでは、細胞培養に必要な基本的知識、注意点、一般的なプロトコルおよび細胞培養に必要な培地、添加剤などをご紹介しています。
▼こんな方にオススメ
・これから細胞培養実験をはじめる方
・コンタミネーションせずに細胞培養したい方
・浮遊性細胞の継代方法や細胞の凍結/融解についてあまり自信がない方

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




