部位特異的変異導入(クローニングの基礎と実験のコツ)

部位特異的変異導入とは
部位特異的変異導入(Site Directed Mutagenesis, SDM)はプラスミド内の特異的な部位に変異を導入するのに有用な方法で、遺伝子の置換、挿入、欠損を行うことができます。変異を導入すると、酵素などの作用機構や病気の原因遺伝子を解析したり、自然界にないタンパク質を産生したりすることもできます。この記事ではPCRをベースにした部位特異的変異法を紹介します。
PCRをベースにした部位特異的変異導入の原理
背中合わせにペアとなるPCRプライマーを用い、片方のプライマーには目的の変異を組み込んでおきます。PCRによって増幅された直鎖のPCR産物をリン酸化し、その後DNAリガーゼで両端を結合します。こうして環状化したベクターを大腸菌に形質転換します。
PCRをベースにした部位特異的変異導入のフロー
部位特異的変異導入は次のフローで行います。
-
変異が入るようにPCRプライマーをデザインする。
-
PCRを行う。
-
PCRのクリーンアップを行い目的のDNA鎖を得る。
-
得られたDNA鎖の5’末端のリン酸化を行う。
-
DNA鎖の末端を結合して環状にする。
-
コンピテントセル(大腸菌など)に導入(形質転換)する。
-
DNAシークエンスで変異が導入されていることを確認する。
以上を図示すると下図のようになります。 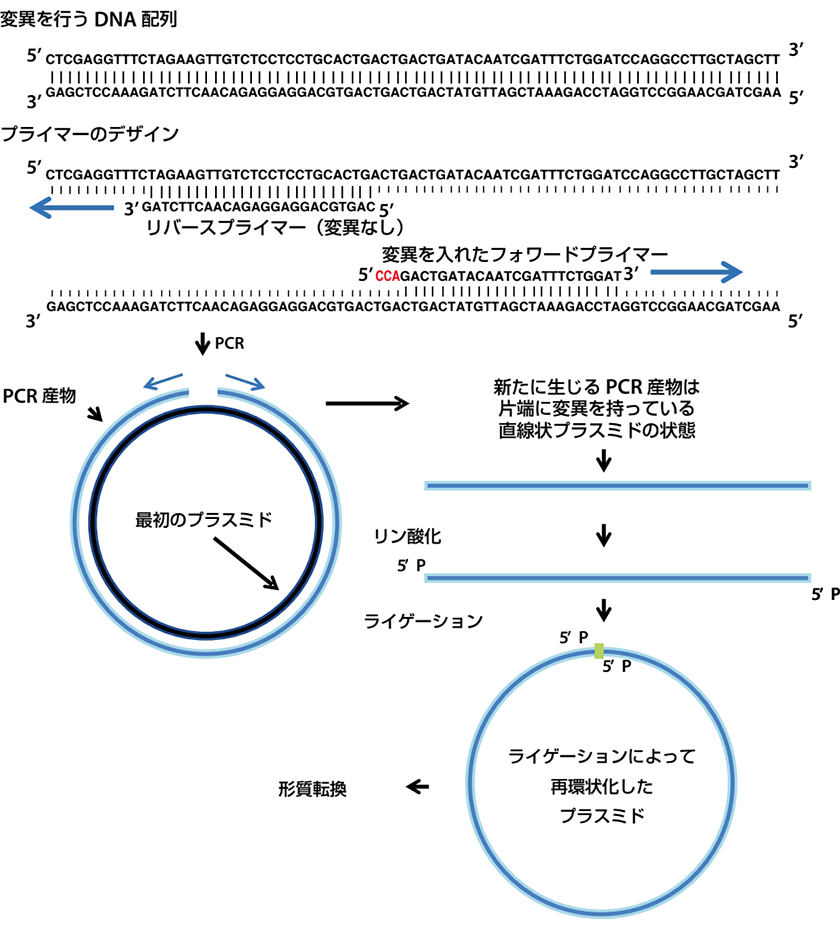 この記事では①~⑤のステップにおける注意点を解説します。
この記事では①~⑤のステップにおける注意点を解説します。
プライマーデザインの注意点
まずは①。今後異なるシリーズの変異を作るときを考えて、フォワードプライマーのみに変異を入れると、リバースプライマーは同じものを使えるので便利です。上の図の例は3 bp置換ですが挿入も同様に行えます。長い置換や挿入が必要な場合は、両方のプライマーの5’端に変異を入れることで対応できます。欠損を行うときは、テンプレートの配列から欠損させたプライマーを用います。 合成されたPCRプライマーは通常5’端にリン酸基が付いていないため、PCR産物をそのままライゲーションして環状化することはできません。そのため、あらかじめ5’端がリン酸化されたプライマーを用いるか、PCR産物をポリヌクレオチドキナーゼ(PNK)でリン酸化する必要があります。作成するSDMが少ない場合は5’端がリン酸化されたプライマーを用いた方がPNKを使用するより経済的です。
PCRの注意点
次に②のステップ。意図しない変異を避けるため、プルーフリーディング(校正)活性のあるポリメラーゼを用いることが重要です。また、PCRは小さいプラスミドの方がより正確に働くため、変異させたフラグメントのサブクローンを作って元のベクターに戻すことも有効です。 PCR反応を行うためには、以下のような組成でPCR反応液を作成します。
<PCR反応液の例>
-
ヌクレアーゼフリーの水……35.5 μL
-
10x DNAポリメラーゼ用バッファー……5 μL
-
フォワードプライマー(最終濃度0.3 μM)……1.5 μL
-
リバースプライマー(最終濃度0.3 μM)……1.5 μL
-
dNTP(最終濃度200 μM)……5 μL
-
テンプレートDNA……1 μL
-
DNAポリメラーゼ……0.5 μL
この反応液を氷上に置き、あらかじめ温めておいたPCRブロックにセットして、下記のプログラムを実行します。
<PCR反応プログラムの例>
-
98℃、60 秒
-
98℃、8 秒
-
55~65℃、20 秒
-
72℃、時間はプラスミドの大きさとポリメラーゼによって異なる。
(一般的に、1 kb 以下の場合は 1 分、それよりも長い配列の場合には、 1 kb につき 1 分の割合で長くする。)
※2~4を27~30サイクル以上繰り返す。
-
72℃、5分
反応後は室温でホールドします。
PCRのクリーンアップの注意点
次に③のステップ。すべてのPCR反応液をアガロースゲルで電気泳動し、泳動後のバンドを切り出します。 ゲルからの抽出キットでDNAをクリーンアップします。クリーンアップの溶出液は30 μL以内にします。
5’端のリン酸化
次に④のステップです。なお、リン酸化されたプライマー(リン酸化オリゴ)でPCRを行った場合、この手順は必要ありません。 ③で得たPCR産物と下記の反応液を混合し、37℃で40分間インキュベートします。 ③で得たPCR産物……4 μL + 反応液(ヌクレアーゼフリーの水……4.5 μL、T4 ポリヌクレオチドキナーゼ……0.5μL、10x T4 DNAリガーゼ用バッファー……1 μL) ※DNAリガーゼ用バッファーはATPが含まれるため、PNKの活性化に使用する。
DNA鎖の末端の結合
最後に⑤のステップ。下記の反応液を氷上で準備し、④の反応後の溶液と混合し、16℃で一晩または室温で2時間インキュベートします。 PNK反応液(④の反応後の溶液)……2 μL + 反応液(ヌクレアーゼフリーの水……6.7 μL、10× T4 DNAリガーゼバッファー……0.8 μL、T4 DNAリガーゼ……0.5 μL)
以上、クローニングの部位特異的変異導入の注意点についてお届けしました。部位特異的変異導入は応用範囲が広い技術です。ぜひ、マスターして、いろいろな研究計画に役立ててみてくださいね。⑥、⑦のステップについては他の記事も参考にしてみてくださいね。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




