【保存版】RNA精製→逆転写→リアルタイムPCRの実験フロー
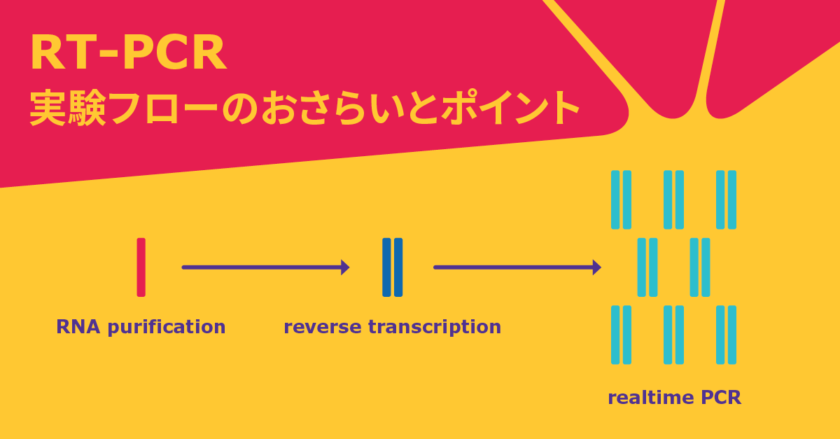
遺伝子発現解析でよく使われるRT-PCR。特に、定量的な解析ができるリアルタイムPCRは、発現量の解析で必要不可欠な手法となっています。しかし、実験がうまくいかなかったり、そもそもどういう原理であるのかあまり理解できていなかったりと、難しい側面があるのも事実です。
そこで、当記事では、遺伝子発現解析の肝となるポイントを3つのステップごとに解説します。
ここでの遺伝子発現解析とは目的とするmRNAの量を定量PCR(qPCR)により計測することです。実験結果、すなわちゴールを得るためのシュートにあたるqPCRの質の向上のみならず、アシストにあたるcDNAの質、一連の実験の起点となるmRNAの取得の質と、美しいゴールにはいずれも重要です。
3つのポイントをしっかりと理解することで、例えゴールに至らなくてもどこを改善すればよかったか振り返り、次の実験に活かせるようになります。
RNAを損傷させず、純度高く精製するコツ
RT-PCR成功の第一歩は、損傷のない、純度の高いRNAテンプレートを容易することです。それぞれのポイントを押さえておきましょう*1。
-
損傷のないRNAテンプレートを得るために
RNaseのコンタミネーションをいかに防ぐか、が重要になります。皮膚にはRNaseが豊富に存在するため、必ずグローブを着用して実験を行います。ガラス容器は事前に必ず滅菌しておき、マイクロピペットのチップなどは滅菌済みのRNase、DNaseフリーのプラスチック製ディスポーザブル器具のみを使用してください。
細胞や組織にもRNaseが豊富に含まれているため、RNase阻害剤を添加します。最も一般的なRNA精製法として、強力なタンパク質変成作用のあるチオシアン酸グアニジンを用いてフェノール・クロロホルム抽出を行う方法があります。 -
純度の高いRNAテンプレートを得るために
逆転写反応を阻害しうる物質を除去するために、エタノールを使用してRNAを沈殿させ、70%エタノールで再度洗浄します。残留するエタノール成分を完全に除去するように注意しましょう。
RNAの純度の確認は、ゲル電気泳動で確認できます。真核生物由来のトータルRNAの場合、18Sと28SのrRNAが明瞭なバンドとして現れます。
rRNAはトータルRNA中の約8割を占め、トータルRNAのうちmRNAはわずか2〜5%しか存在しないと考えられています*2。
そこで、mRNAをターゲットとする場合には、トータルRNAをそのまま用いるのではなく、mRNAを単離する必要があります。特に存在量が少ないmRNAがターゲットの場合、RT-PCR成功の確率を高めることができます。
mRNAを単離するには、市販の各種キットを利用するのが最も簡単な方法です。キットの多くは、mRNAの3’末端にあるポリAを利用して単離します。精製されたmRNAは、ゲル電気泳動で500 bpから8 kbの間でスメアー状に確認できます。
miRNAや短いnon-coding RNAなどのsmall RNAをターゲットにする場合、専用の単離方法を選択する必要があります。市販のキットを使う場合には、必ず「small RNAが単離可能」と明記されていることを確認しましょう。
なお、精製後のRNAは、短期間であれば2〜8℃で保存できますが、長期保存する場合には-70℃で保存します。
逆転写を行うときの酵素やプライマーの選択
PCRはDNAを増幅させる反応なので、RNAが対象のときには逆転写酵素を用いてRNAからcDNAを作成する必要があります。
逆転写酵素と一言に言っても、逆転写できる塩基の長さ、最適温度、感度は様々です。ターゲットとなるRNAから完全長のcDNAを合成できる逆転写酵素を選択しましょう。
鋳型となるRNAが二次構造を取りやすい、あるいはプライマーが非特異的な結合をしやすい場合には、最適温度の高い逆転写酵素を用いて反応温度を上げることで、正確な逆転写が期待できます*3。
RT-PCRには、逆転写反応とPCRを別々のチューブで行う「ツーステップ(2 step)操作」と、逆転写反応とPCRと同一チューブで連続的に行う「ワンステップ(1 step)操作」の2種類に大別されます。
どちらを選択するかによって、逆転写時のプライマーの設計が異なります。
-
ツーステップ操作
逆転写とPCRを別々の条件で実行できるので、それぞれ最適な条件下で効率よく正確な逆転写とDNA増幅が期待できます。逆転写したcDNAを複数のチューブに分け、それぞれに別々のプライマーを加えれば、複数のパターンで解析ができます。
ツーステップ操作でよく使われるプライマーのタイプには、オリゴ(dT)Nとランダムヘキサマーがあります*4。
オリゴ(dT)Nは、ほとんどのmRNAの3’末端にあるポリAを認識するもので、ターゲットがmRNAの場合には汎用的に用いることができます。ただし、しばしば非特異的な結合を起こす、ポリA末端を含まないmRNAには適用できない、などの落とし穴があります。
ランダムヘキサマーは6塩基からなるプライマーで、RNA全般にわたって結合能があり、様々な長さのRNAに対応します。プライマーの比率を上げると、同じRNAテンプレートでもより多くの場所でプライマーが結合するので、合成されるcDNAの長さが短くなります。完全長のcDNAを得にくい場合の解決策の一つとなります。 -
ワンステップ操作
一つのチューブで操作が完結するため、所要時間が短縮し、コンタミネーションのリスクが低くなる特長があります。ピペッティング操作の回数が減るため、精度が求められる測定にも向いています。
その一方で、同じ溶液中で逆転写とPCRという別々の反応が行われるため、プライマーの結合能が重要になります。
そこで逆転写に使用するプライマーは、オリゴ(dT)Nやランダムヘキサマーではなく、特定のRNAだけを認識できる「配列特異的プライマー」を設計する必要があります。このプライマーは逆転写だけでなくPCRにも用いるため、増幅したい領域の両端に結合できるよう2種類用意する必要があります。
プライマーの設計においても、ゲノムDNA由来のコンタミネーションを区別できるよう工夫する必要があります。具体的には、mRNAで隣り合うエクソンの配列に結合できるタイプと、隣り合うエクソンにまたがって結合できるタイプがあります*5。
逆転写については、以下の記事でも触れています。
PCRとRT-PCRの基本原理 | M-hub(エムハブ)
リアルタイムPCR(qPCR)におけるプローブ選択
RT-PCRによってcDNAを作成したら、cDNAを鋳型にPCRを行います。cDNA(あるいは元のRNA)の濃度を推定する手法には、定量性に優れたリアルタイムPCRがあります。
リアルタイムPCRでは、DNA増幅を蛍光強度で検出して逆算することで、反応前のcDNA量、すなわちRT-PCRではターゲットRNAの量を推定できます。
-
2種類の蛍光検出方法
検出方法は、配列に依存しない方法と、配列特異的プローブを用意する方法の2種類があります*6。
配列に依存しない方法では、溶液中では蛍光を発せず、2本鎖DNAと結合すると分子の構造変化により蛍光を発する試薬を用います。代表的な試薬はSYBR® Green Iです。実験デザインは比較的簡単ですが、プライマーダイマーなどにも結合するため、事前に融解曲線分析を行う必要があります。
融解曲線とは、温度を徐々に上げて2本鎖DNAを1本鎖に解離(融解)させるときの蛍光の変化をグラフ化したものです。このグラフを見ることで、非特異的副産物の存在を確認できます*7。
もう一つの方法である配列特異的プローブにはいくつかの種類がありますが、ほとんどは蛍光共鳴エネルギー転移(FRET)という現象を利用します。比較的多く用いられる加水分解プローブでは、溶液中または1本鎖DNAと結合しているときには、レポーター色素からの蛍光が抑制されています。
DNA合成中に、DNAポリメラーゼの5’ヌクレアーゼ活性によりプローブが加水分解されると、レポーター色素から蛍光が発せられます。この蛍光を検出することでDNA量を推定します。融解曲線分析は不要ですが、SYBR Green Iなどと異なり、ターゲット配列を認識するプローブとプライマーの組合せ、特にその位置とTm値に気を付ける必要があります。 -
絶対定量と相対定量
RT-PCRの定量解析では、通常、リファレンス遺伝子との相対値で表す「相対定量」を用います*8。相対定量は、mRNA発現解析に適した方法で、同一サンプル中のリファレンス遺伝子と比較します。リファレンス遺伝子は、どの組織や細胞でもほぼ発現量が変わらないと想定されるものを選択します。
なお、リアルタイムPCRでは、ターゲット分子の濃度を絶対値で示すことができる「絶対定量」という方法もあります。ウイルス学や微生物学など、遺伝子コピー数の決定が求められる分野に適しています。
リアルタイムPCRについては、下の記事でも詳しく解説しています。
RT-qPCRのためのqPCRの基礎とコツ | M-hub(エムハブ)
原理を理解して事前準備を怠りなく
RT-PCRは、DNAのPCR以上に各ステップで考えるべきポイントや注意点が多く、事前の準備が重要になります。選択肢も多くあるので、実験目的に合わせて適切に選ぶ必要があり、基本的な原理も含めて理解しておきましょう。
リアルタイムPCRについて、より詳細に知りたい方へ
『PCR技術のすべて〜基礎から最新技術まで〜』をダウンロードする
RNA抽出やクローニング、遺伝子導入にも興味がある方へ
『遺伝子基礎じっけんレシピ集2015』をダウンロードする
参照元
*1,3,5,6,7,8 『PCRアプリケーションマニュアル[第3版]』
*2,4 『PCR技術のすべて〜基礎から最新技術まで』

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須