免疫沈降で注意してほしい5つのステップ
免疫沈降法とは
抗体‐抗原沈降法または免疫沈降法(IP)は、細胞や組織溶解液中の複合的タンパク質混合物から、特定の抗原を分離するために用いられます。この手法は、貴重な探索ツールであることが実証されており、特定の抗原に関する重要な情報を確認するために、多くの実験室で日常的に取り入れられています。免疫沈降法の用途には、機能性試験のための小規模な抗原精製、N末端配列解析、タンパク質‐タンパク質相互作用の検討、細胞や組織中における抗原の相対的存在量や化学量論的分布の測定などがあります。
免疫沈降アッセイが成功するか否かは、元のサンプルにおける抗原の存在量と、抗原に対する抗体の親和性(通常108 M-1以上の親和性が必要となります)という2つの要因に大きく依存しています。
また、手順の開始前に、適切な実験コントロールが設置されていることを確認しましょう。コントロール抗体は、可能な限り特異抗体の性質に類似している必要があります。ポリクローナル抗血清では、同一の動物から得た免疫化前の血清が、理想的な陰性コントロール抗体となります。しかし、そのような血清が利用できない場合には、同一種の別の動物から得た同濃度の免疫化されていない(正常な)血清でも十分です。
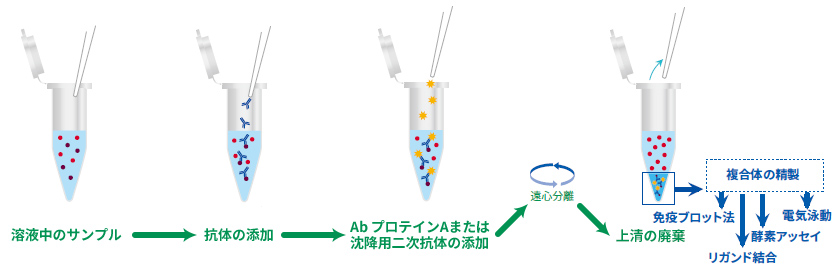
免疫沈降法の手順は、次の5つのステップに分けられます(下図)。ここからは各ステップについて順番に解説していきます。
- 抗原の標識(オプション)
- サンプル調製(抗原を遊離させるために細胞を溶解)
- 抗原抗体複合体の形成
- 免疫複合体の沈降
- 解析
-
抗体の標識
抗原は、放射性前駆体(3H-チミジンなど)を含有する媒体中でのインキュベーション、表面タンパク質のヨウ素化またはビオチン化、放射性水素化ホウ素ナトリウム処置、またはその他の一般的な技術によって標識可能です。抗原の標識は任意で、ほとんどのIPアッセイでは必要ありません。
-
サンプル調製
まず、細胞または組織サンプルから抗原を抽出します。その際、抗体によって認識可能な形態のまま、効率的に抗原を取り出さなければなりません。これには、細胞内における抗原の位置(核内、細胞質内、膜結合型など)を考慮し、抗原の構造的な完全性への影響を最小にしながら、抗原の抽出に最適な方法を決定する必要があります。
抽出/細胞溶解プロトコールの開始前に、免疫沈降法によってどのような情報を得たいのか考えてみましょう。例えば、機能性試験のために機能性タンパク質を抽出する必要があるか。また、タンパク質‐タンパク質相互作用を妨害するかどうか、細胞内で標的抗原と相互作用する可能性があるタンパク質を同時に免疫沈降するかどうかについても考慮する必要があるかもしれません。これらの点や、その他の考慮すべき点に基づいて、適切な溶解方法を決定します。効果的な溶解方法は、経験的に判定されることが多いようです。
溶解手順において最も重要な点は、溶解バッファーの組成です。溶解バッファーのイオン強度(塩濃度)、pH、界面活性剤の種類は、抽出効率や抗原の完全性に著しく影響を及ぼす可能性があります。通常、pHが弱アルカリ性でイオン強度が低いバッファーは、タンパク質の可溶化に好都合ですが、塩濃度が高くpHが低いバッファーは、抗原の変性や溶液中での凝集を引き起こす可能性があります。界面活性剤の選択も重要で、抗原の細胞内における分布や、サブユニットをはじめとするタンパク質‐タンパク質相互作用を保持する必要があるのかどうかなど、多数の要因を考慮して選択する必要があります。
一般的に、非イオン性(例、Triton® X-100、NP40)または両性イオン性(例、CHAPS)界面活性剤は、非共有結合的なタンパク質‐タンパク質相互作用を保持する傾向にありますが、イオン性界面活性剤(例、SDS、デオキシコール酸ナトリウム)は、タンパク質‐タンパク質相互作用を変性させ、抗体が標的抗原を認識する能力に有害な作用を与える恐れがあります。
使用する溶解方法に関わらず、細胞溶解手順中に遊離するプロテアーゼによる標的抗原のタンパク質分解を防止するため、溶解バッファーには必ず適切なプロテアーゼ阻害剤を加える必要があります。また、すべての溶液は事前に冷却し、溶解手順のすべてのステップは氷上で実施します。
溶解に必要な細胞数は、細胞株や、サンプル中において予測される標的抗原の存在量によります。一般的に、細胞溶解液は107細胞以上の細胞から調製し、溶解バッファー1 mLあたり107細胞とします。細胞溶解液の調製後、タンパク質濃度を測定し、細胞溶解液の濃度を溶解バッファーかPBSで2~5 mg/mLに調節して用います。直ちに使用しない抽出液は分注し、急速に凍結させて今後の使用のために-70 ℃で保存しましょう。抽出液のタンパク質濃度が0.1 mg/mL未満の場合は、凍結前に高純度BSAを1 %(w/v)の濃度で添加します。
Triton X-100は波長280 nmの光線を強力に吸光します。そのため、溶解バッファーにTriton X-100を用いた場合は、280 nmにおける吸光度からサンプル中のタンパク質濃度を判定できないので注意しましょう。一般的に、多くの細胞溶解液では、界面活性剤、還元剤、脂質が含まれていても、Direct Detect™ Quantitation System(カタログ番号:DDHW00010-WW)などのFTIR分光法による直接的なタンパク質の定量によって、総タンパク質量を正確に定量できます。
-
抗原抗体複合体の形成
抗原を抽出した後、抗体を細胞溶解液に添加し、免疫複合体を形成させます。
-
免疫複合体の沈降
免疫複合体の沈降には、以下の材料を用います。
• プロテインAまたはプロテインGアガロースビーズ
• 沈降用二次抗体
• プロテインAを含有する黄色ブドウ球菌細胞(カタログ番号 507858)プロテインAまたはGに対する抗体の親和性は、免疫グロブリンのサブクラスや由来する種に依存します。例として、プロテインAは、すべてのウサギ由来一次抗体の免疫沈降に特に優れていますが、ニワトリ由来の抗体には適していません。
マウス一次抗体の免疫沈降にプロテインAを用いる場合には、プロテインA/Gを加える前に、5 μgのウサギ抗マウスIgG(沈降用二次抗体)を添加することが推奨されています。ゆっくり混合し、プロテインA/Gを加える前に、4 ℃でさらに30分間インキュベーションしてください。沈降にプロテインAまたはGアガロースを用いる場合、前述の手順に従い調製した抗原抗体複合体の量を沈降させるには、10~20 μLの50%プロテインA/Gアガローススラリーで十分です。
-
解析
このようにして免疫沈降したペレットは、2×SDSサンプルバッファーに再懸濁し、SDS-PAGEによって分離することが可能です。また、精製した免疫複合体は、酵素解析、リガンド結合アッセイ、さらなる免疫反応やその他の免疫化学解析にも用いることができます。これらの手法を免疫沈降法と併用することによって、抗原について多大な情報が得られます。
以上、免疫沈降法の手順と注意点について解説しました。幅広く用いられる手法なので、ぜひ参考にして実験に活かしてください。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須