<研究最前線>佐々木雄彦-脂質に注目して病態形成を明らかにする

東京医科歯科大学難治疾患研究所教授の佐々木雄彦先生は、生体内に存在する脂質と疾患との関係に注目し、脂質の生理活性と作用機序の解明を進めています。脂質研究・分析技術の歴史を振り返りながら、佐々木先生の研究テーマについてお話を伺いました。
分析技術の向上により相次ぐ新規脂質の同定
-現在の研究テーマを教えてください。
脂質に着目した医学・生命科学の研究を行っています。生命の中では、遺伝子をもとにタンパク質が作られ、タンパク質が多様な代謝産物を作ります。代謝産物のうち水に溶けない物質、国際純正・応用化学連合(IUPAC)による定義では“非極性溶媒に可溶な物質”が脂質です。脂質は、生体内では3つの機能を有しています。膜形成による細胞の区画化、細胞内外のシグナル伝達、エネルギー貯蔵、です。脂質は遺伝子やタンパク質と比較して研究が遅れていましたが、近年の分析技術の向上により新規構造・機能を持つ脂質の同定が相次いでいます。
-脂質の研究が遅れていたのはなぜですか?
水に溶けないという性質上、解析が難しかったのです。水に溶けないからこそ細胞膜の成分として細胞を区画できるのですが。それに、遺伝子は4種類の核酸塩基、タンパク質は20種類のアミノ酸から構成されるという規則がありますが、脂質は構造がきわめて多様であることも研究が遅れている理由です。
-近年の分析技術の向上とは?
エレクトロスプレーイオン化という方法が開発され、それを応用して液体クロマトグラフィーと質量分析を組み合わせる分析方法Liquid Chromatography-Mass Spectrometry(LC/MS)が登場したことです。LC/MSを用いることで脂質をより詳細に分類できるようになると、生体内には何だかわからない脂質がとにかくたくさんあることがわかってきました。さらに、以前の脂質研究の実験では放射性同位体を扱うことが多かったのですが、LC/MSではそれも必要ありません。ヒトのサンプルでも分析できるようになったのは大きな進展です。
-新しい脂質が多く見つかってきたのですね。
その通りです。次にやるべきことは、それらの脂質が何をしているか調べることです。現在、私たちが医学・生命科学研究として取り組んでいるのは、病気のときだけ、あるいは病変部でのみ量が増えたり減ったりする脂質を見つけ、その脂質が病態形成と因果関係があるのか検証することです。その手順として私たちは、「病態生理化学/脂質生物学研究の4原則」を提唱しています。
-それはどのようなものですか?
ドイツの細菌学者ロベルト・コッホが感染症の病原体を特定するために作成した指針「コッホの4原則」を真似たものです。
- ヒトのある病態で変化する特定の脂質を見出すこと
- その脂質の代謝酵素を同定すること
- その代謝酵素を実験動物で欠損/発現させて同じ病態を起こすこと
- その病態で1と同じ脂質の変化を見出すこと
脂質そのものは遺伝子にコードされていませんが、代謝酵素をコードする遺伝子を改変することで脂質の量を変えることができます。また、この4原則の代謝酵素を、「脂質が作用する標的タンパク質」に置き換えるバージョンもあります。こういうロジックで研究を進めています。
脂質と疾病の関係
-具体的にターゲットとなる脂質はあるのですか?
私たちが着目しているのは、形質膜や細胞内小器官の膜を構成するリン脂質です(図1)。
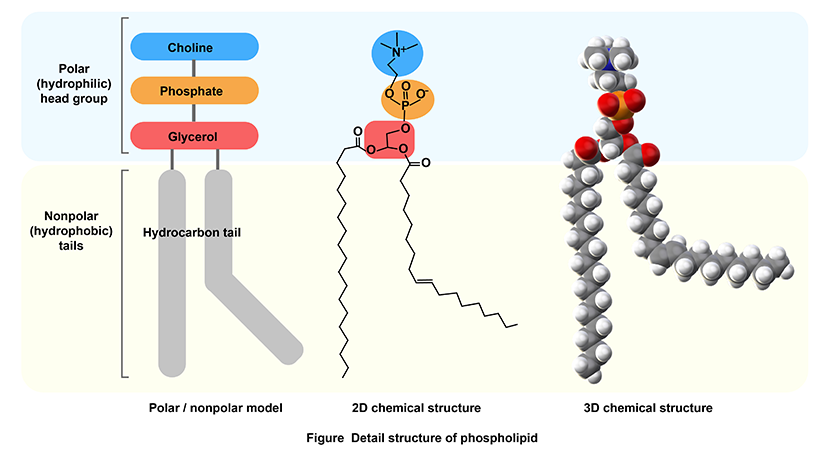
図1 リン脂質の基本構造
生体に最も豊富に存在するホスファチジルコリンを例に示している。
(出典元:Molecular biology of the Cell 5/e (© Garland Science 2008))
リン脂質は、グリセロールに脂肪酸が2つ、リン酸が1つ結合した共通の構造に親水性の物質が結合したもので、一つの分子内に疎水性部分と親水性部分をもちます。この特性のため、自己組織化によって脂質二重膜を形成します。親水性の部分を「ヘッドグループ」とよんでいるのですが、ヘッドグループには構造が異なる、多くの種類があるあります。「種類」と言いましたが、ヘッドグループの構造の違いで、何種類という数え方をします。細胞の区画化のためだけならリン脂質の多様性は必要ありません。ヘッドグループの構造の違いによってシグナル伝達などの機能が異なるために生物は多種のリン脂質をもっていて、私たちはその機能解明に取り組んでいます。
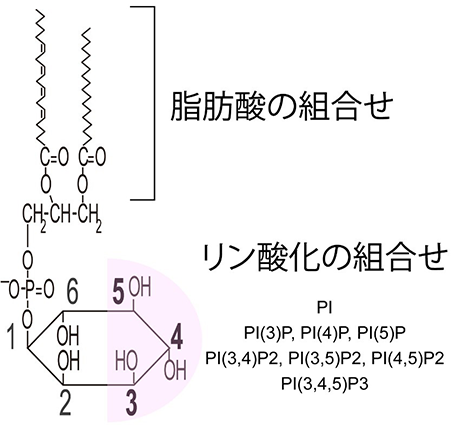
図2イノシトールリン脂質の構造
リン脂質の一種ホスファチジルイノシトールがリン酸化されることで8種類のイノシトールリン脂質が生成されて、細胞膜に存在する。
(出典元:佐々木先生提供資料)
疾患との関連で注目を集めているリン脂質に、イノシトールリン脂質群(PIPs)があります(図2)。PIPsはヘッドグループであるイノシトールがもつ水酸基のどこにリン酸基が結合するかによって8種類に分類されます。PIPsの研究が大きく進んだきっかけの1つは、1988年にルイス・カントレー教授らによる、イノシトール環の3位水酸基をリン酸化する酵素「PI3キナーゼ」の発見です。
私たちは1998年に、イノシトール環の3、4、5位水酸基の三カ所がリン酸化されたPIPsであるPI(3,4,5)P3に対して、3位のリン酸基を脱リン酸化する酵素「PTEN」が機能しないノックアウトマウスを作製し、がんが誘発されることを明らかにしました(https://www.sciencedirect.com/science/article/pii/S0092867400817808)。鈴木聡先生(現神戸大学大学院医学系研究科・教授)を中心にノックアウトマウスの病態を解析して、私は脂質の動態を解析しました。脂質代謝酵素を欠損する動物を使って発がんにおける役割を明らかにしたのは、これが世界で初めてでした。続いて、PI3キナーゼのノックアウトマウスを作製して、炎症におけるPIPs代謝の役割も明らかにしました(https://science.sciencemag.org/content/287/5455/1040/tab-figures-data)。20年も前の論文ですが、今でも多く引用されています。
-リン酸基の位置や数によって機能が異なるのはなぜですか?
PIPsはタンパク質に結合して、タンパク質の活性や細胞内での位置を制御することがわかっています。PIPsのリン酸化パターンが異なると、作用するタンパク質が変わり、その制御様式に多様性が生まれるからだと考えられます。
現在私たちは、哺乳動物で約50種類ある脂質代謝酵素一つひとつについてノックアウトマウスを作製し、いろいろな細胞、組織でどのような変化が起きるか観察しています。これまでに、がんの発生だけでなく転移や血管新生、さらには神経疾患、自己免疫疾患、炎症性疾患、脂肪代謝異常、糖代謝異常、白内障、骨粗しょう症などの疾患との関係がわかってきました(図3)。
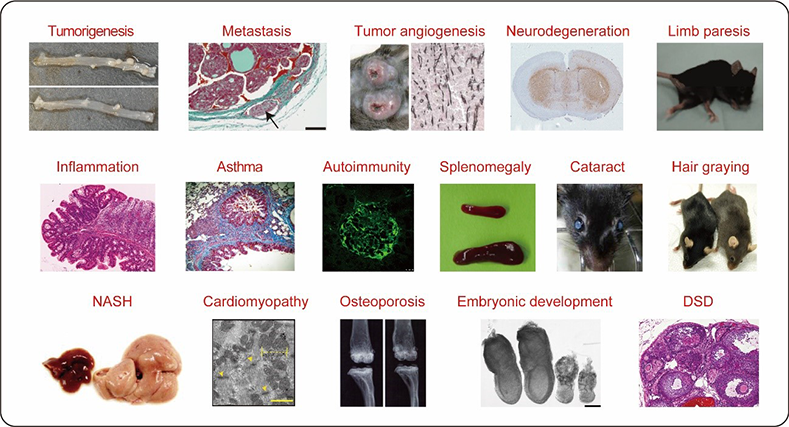
図3 イノシトールリン脂質代謝異常によってあらわれる様々な病態
代謝酵素欠損マウスの表現型やヒト疾患の遺伝子解析によって、イノシトールリン脂質のバランスが崩れると幅広い臓器、組織で病態が出現することが解明された。
(出典元:佐々木先生提供資料)
脂質からがんの薬剤感受性と予後の予測を導きたい
-これらの研究は応用にどうつながるのですか?
先ほどの例でお話ししたPI3キナーゼやPTENについては、ヒトのがんにおいても当てはまることがわかっています。がん細胞の中では遺伝子の変異によって、リン酸化酵素であるPI3キナーゼの機能が亢進していたり、その逆反応を触媒する脱リン酸化酵素であるPTENの機能が消失している場合が多く見られています。つまり、PI(3,4,5)P3が通常よりも多い状態になっていると予想されます。がんの種類によってこれらの変異の割合に差はありますが、概ねこのような傾向が見られます。実際に、PI3キナーゼの阻害薬が作られ、リンパ球のがんであるリンパ腫の治療で使われています。ある遺伝子の変異やタンパク質の異常をターゲットにした「分子標的薬」の一つです。
-すでに応用されているのですね。
はい。ところが、PI3キナーゼ阻害薬の効果が証明され、治療に使うことができる癌の範囲はすごく限られています。癌のタイプごと、あるいは、患者さんごとにPI3キナーゼ阻害薬が効いているかどうかを評価するときに、患者さんの遺伝子の変異があるのかないのか、どんな変異があるかなどが調べられていますが、今のところ明確な関連性は見つかっていません。そこで私たちは脂質に注目し、脂質プロファイルによってがんの分子標的薬の感受性を予測できないか、と考えています。
-脂質をバイオマーカーとして使うということですか?
その通りです。この種の薬のターゲットは、その脂質を作る酵素なので、最終的な脂質の量がどうなっているのかということが大事です。また、別のバイオマーカーとしては予後予測があります。患者さんに対してより積極的な治療をすべきなのか、医師として知りたい情報です。そこで、脂質プロファイルは予後予測に使えるとも考えています。
がん遺伝子のことを「オンコジーン(oncogene)」と言いますが、私たちはがんに関連する脂質を「オンコリピッド(oncolipid)」とよんでいます。オンコリピッドの研究を進めることで、がん患者の数%でもいいから命を救えるような薬の開発につながってほしいと願っています。
目の前で起きていることを見逃さない眼力を大切に
-今後の研究の方向性について教えてください。
一つはPIPsの脂肪酸部分についての研究を深めたいと考えています。現在、多くの研究者たちはヘッドグループに注目しています。世界中が採用しているPIPsの分析法である陰イオン交換クロマトグラフィーでは、脂質の脂肪酸部分を切断し、イノシトール環のリン酸パターンのみに着目して測定します。脂肪酸を無視して十把一絡げにしているのです。脂肪酸には、炭素数や二重結合の数が異なる種類が多く存在するにもかかわらず、です。
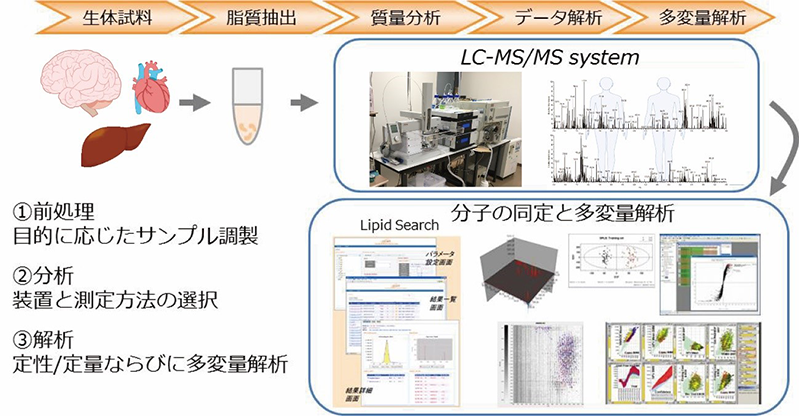
図4 脂質プロファイリングによる疾患の層別化
生体試料に含まれるPIPsや新種リン脂質など、数百種類のリン脂質を包括測定してサンプルを性格づけることで、疾患のバイオマーカーや介入の作用点を探る。
(出典元:佐々木先生提供資料)
私たちは、新しい質量分析の方法を開発して、脂肪酸の構造も分析できるようにしました(図4)。すると、がんをはじめ様々な病気でPIPsの脂肪酸のパターンが大きく変化していることがわかりました。また、健常者においても、臓器によって、さらには同じ脳でも大脳皮質と他の部位とでは脂肪酸のパターンが異なることがわかってきています。
-なぜそのような違いができるのですか?
脂質が細胞応答や生命現象を導くときには結合するタンパク質があり、種々様々なタンパク質の活性制御に脂肪酸が大きな役割と担っているためであると思われます。実際に、分子レベルで挙動をシミュレーションする分子動力学法を用いてコンピュータ上で脂質二重膜を再現すると、脂肪酸の種類によって明らかに脂質の動きやタンパク質との結合が違うのです。慶応義塾大学理工学部の山本詠士博士との共同研究です。今後はこうした物理化学や計算科学の研究者も巻き込んで脂質の研究が進むと思います。
-まさに、次のレベルに脂質研究が進んでいるのですね。
これまで大雑把に「ある種の脂質」と括られていたものが分析技術の進展によって分子構造をもとに細分化され、生体内での分子メカニズムがわかるようになってきたというのが、最近の脂質研究の進歩であると言えます。また、ヘッドグループが違う新種リン脂質が私たちの研究室でいくつか発見されていますので、予期できない面白い展開を期待しているところです。
-その中で心がけていること、学生に指導していることは何ですか?
眼力ですね。細かいことにこだわり過ぎると研究は全然進みませんが、大事なことが目の前で起きているのに見逃すのはもったいない。そこの判断がしっかりできるかどうか、です。例えばPI3キナーゼを発見したカントレー教授らは、薄層クロマトグラム上の脂質スポットの数ミリメートルの移動度の違いからPI3キナーゼの発見にたどり着きました。こういう眼力です。
実験で仮説に合う結果が得られなくても全然問題なく、重要なのは、転んでもただでは起きないような実験の計画です。どのような結果が出ても、「こうだったらこう考えられる」という状態に持っていけるかどうかが大きな違いを生み出します。講義の時に言っていますし、普段はこれしか言っていないかもしれません。でも、それくらい大事なことです。
<プロフィール>
佐々木雄彦(ささきたけひこ) ラボホームページ
東京医科歯科大学 難治疾患研究所 病態生理化学分野/大学院医歯学総合研究科 脂質生物学分野 教授
1969年生。1992年 東京大学 薬学部 卒業(宇井理生教授)。1997年 東京大学 大学院薬学系研究科 博士課程修了(堅田利明教授)。1997-2000年 オンタリオ癌研究所 ポスドク。2000-03年 東京都臨床医学総合研究所 研究員。2003-04年 秋田大学医学部 主任研究員、2004- 秋田大学医学部 微生物学講座 教授(-09年)、大学院医学系研究科 教授(-18年)、2018年から現職。2008年文部科学大臣表彰若手科学者賞、2011年日本生化学会柿内三郎記念賞

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




