<研究最前線>泊幸秀-古き良き生化学にこだわる姿勢

東京大学定量生命科学研究所教授の泊幸秀先生は、タンパク質に翻訳されないRNAである「ノンコーディングRNA(ncRNA)」に注目し、その機能や原理の解明に取り組んでいます。研究内容や、生化学的手法にこだわる理由について、お話を伺いました。
小分子RNAの一生を解明する
-現在の研究テーマを教えてください。
ノンコーディングRNAの中でも、20〜30塩基の小分子RNA(small RNA)に注目しています。RNAというと一本鎖の状態を想像されるかもしれませんが、小分子RNAは二本鎖RNAとして作り出され、アルゴノート(Argonaute)というタンパク質に積み込まれると一本鎖になり、RISC(RNA-Induced Silencing Complex)という複合体を形成します。RISCは、積み込まれたRNAの相補的な配列領域を持つメッセンジャーRNA(mRNA)を認識して、そのmRNAからのタンパク質合成を抑制します。このような、小分子RNAによる遺伝子発現制御を「RNAサイレンシング」と言います。
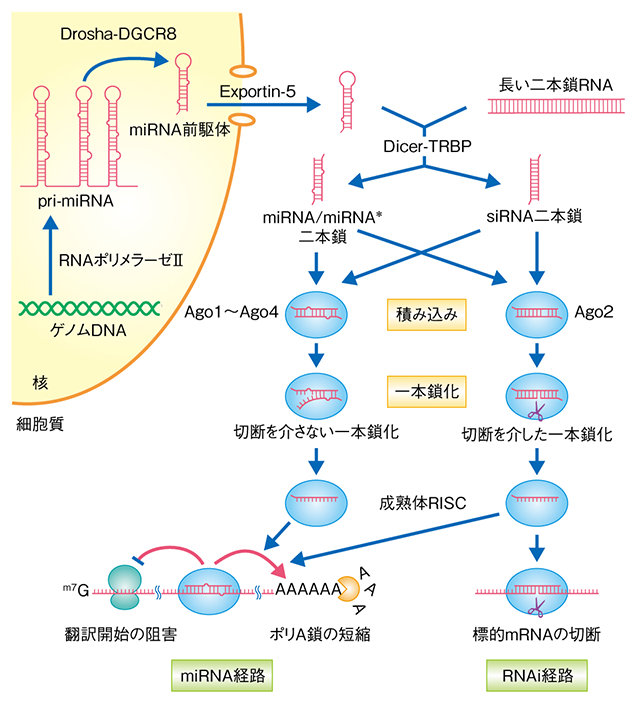
ヒトにおけるRNAサイレンシングの分子機構
Ⓒ2012佐々木浩・泊幸秀 Licensed under a Creative Commons 表示 2.1 日本License
私たちは、小分子RNAがアルゴノートと出会い、アルゴノートにきちんと積み込まれてRISCを形成し、標的mRNAからのタンパク質合成を抑制するまでの、いわば“小分子RNAの一生”に関わる様々なステップについて、生化学的手法にこだわって研究をしています。
-生化学的手法にこだわる、とはどういうことですか?
私たちが大切にしている生化学とは、20世紀後半から行われている昔ながらの考え方です。手間も時間も労力もすごくかかりますよ。まずは細胞をうまくすり潰して抽出液を作り、生体内で起きている一連の化学反応をできるだけ壊さずにそのまま試験管の中に取り出します。複雑な化学反応のミックスを忠実に再現してから、次に私たちが見たい反応を丁寧に取り出して責任因子を同定します。最後に全ての責任因子を精製し、それらをもう一度組み合わせて生体内の反応が再現できれば、その現象を理解したことにしましょう、というのが古典的な生化学の作法です。私たちの研究室では、生化学をずっと自分たちの強みや武器として研究を続けています。
-泊先生が小分子RNAの研究を始めたのはいつごろですか?
学部の4年生の時に故・渡辺公綱先生の研究室に配属され、当時はtRNAとそれに関連する酵素の研究をしていました。その後、アメリカでポスドク時代を過ごした研究室が小分子RNAを研究テーマにしていて、そのときから現在に至ります。
貝の形をしたアルゴノートを開ける
-最近の研究成果を教えてください。
小分子RNAがアルゴノートに積み込まれRISCが作られるまでには具体的に何が起きているのか、ということを研究室のメインテーマの1つとしてやってきました。一見すると単純な反応のように思えますが、この反応にはATPによるエネルギーが必要不可欠であることが生化学的解析からわかっていました。しかし、ATPを使って何が起きているのか、その実態は長らく不明でした。最近私たちは、「シャペロン」がATPを使ってアルゴノートの構造変化を引き起こしていることを明らかにしました(https://doi.org/10.1016/j.molcel.2018.04.010)。
-シャペロンとは何ですか?
他のタンパク質が正しく機能するために必要な構造を取らせるためにはたらくタンパク質の総称です。シャペロンという名前は、社交界にデビューする若い女性に付き添う“介添人”に由来します。代表的なものが熱ショックタンパク質(HSP)です。HSPの中には、熱ショック時に限らず、平常状態でも細胞内で常に高発現しているものもあり、様々なタンパク質の手助けをしています。
私たちは、1分子のアルゴノートを2つの異なる蛍光色素で標識し、蛍光共鳴エネルギー移動(FRET)法を用いた1分子イメージングで解析しました。その結果、2つのHSP(Hsp70とHsp90)が協力して、アルゴノートの構造を大きく変化させていることがわかりました。
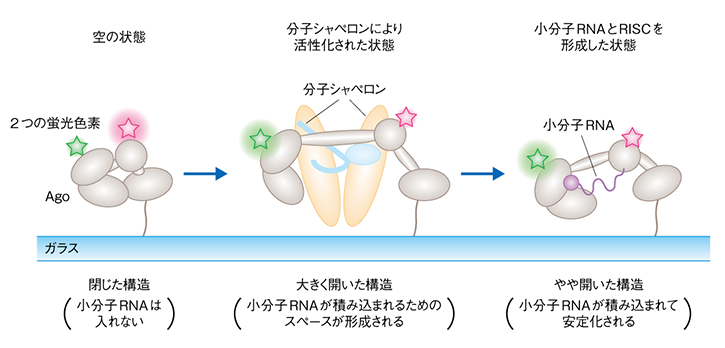
FRETでは、2つの蛍光色素を用いる。2つの蛍光色素の距離が近いとエネルギー移行により強い蛍光を発するが、距離が離れると蛍光強度が弱まる。これにより、標識した分子の構造変化を可視化できる
Ⓒ2018 坪山幸太郎・泊幸秀 Licensed under a Creative Commons 表示 2.1 日本 License
-どういうことですか?
アルゴノートは単独では閉じた構造をしているため、かさ高い小分子RNAを積み込むためにはアルゴノートの構造が大きく開く必要があります。開くだけならHsp70で可能なのですが、それではすぐに閉じてしまうこと、Hsp70がこじ開けた状態を安定化するのがHsp90であり、こうしてようやく小分子RNAを積み込む空間がアルゴノートの中に作られることを見出しました。ここまでの一連の謎を解き明かすのに10年くらいかかりましたが、満足のいくかたちで決着を見たと思っています。
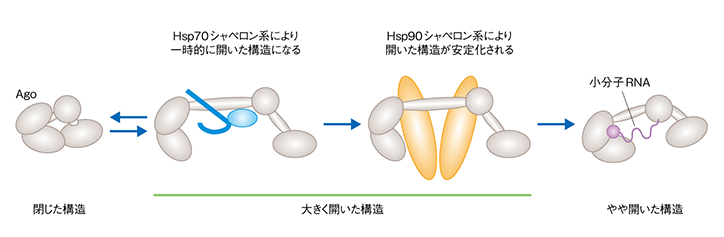
最初にHsp70がアルゴノートの構造を一時的に開き、その後でHsp90が開いた構造を安定化させる。最終的にアルゴノートに小分子RNAが積み込まれてRISCが作られ、やや開いた構造で落ち着く
Ⓒ2018 坪山幸太郎・泊幸秀 Licensed under a Creative Commons 表示 2.1 日本 License
-日本語のプレスリリース(https://www.u-tokyo.ac.jp/focus/ja/articles/z0508_00042.html)では貝を開くように例えていますね。
これは1分子イメージングの共同研究者である多田隈尚史先生(現在 中国上海科技大学 助理教授)が作ったムービーです。Hsp70とHsp90の役割を持たせたブロック人形の2人が協調して、アルゴノートに例えた貝を開けている様子です。アルゴノートはその形状から、よく貝に例えられるんですよ。
-この報告の直後には「イルカ(Iruka)」というかわいいネーミングのタンパク質に関する論文を発表しています(https://www.cell.com/molecular-cell/fulltext/S1097-2765(18)30893-1)。これは何でしょうか?
小分子RNAと結合していない“空の”アルゴノートを分解させる目印となるユビキチンを付加するユビキチンリガーゼです。イルカタンパク質を介して空のアルゴノートが積極的に分解されることで、アルゴノートタンパク質のプール全体としての品質を保っていると考えています。名前の由来ですが、もともとアルゴノートは植物で見つかったもので、その変異体は葉が細くなって巻いてしまうのですが、その姿がカイダコ(貝ダコ、Argonauta argo)に似ていることから命名されました。また、地中海などではカイダコはイルカによく捕食されるという報告があることから、アルゴノートの分解に関わるということでイルカと名付けました。以前、アルゴノートに関する論文(https://www.cell.com/molecular-cell/issue?pii=S1097-2765(09)X0008-0#)を出してジャーナルの表紙のデザインを任されたときには、わざわざカイダコを取り寄せて写真を撮ったこともありましたよ(笑)。
ヘロヘロしたヒーロー
-タンパク質について新たな発見があったとか。
実はアルゴノートの研究をしていく中で、アルゴノートを精製すればするほど性質が不安定になる現象に遭遇しました。ところが、精製したアルゴノートに細胞の粗抽出液を加えると、アルゴノートの性質が回復して安定化します。しかも、細胞の粗抽出液を加熱しても有機溶媒処理などを行ってもアルゴノートの安定化作用が残っているのです。普通のタンパク質だったら活性がなくなるはずです。そこで何かあると思って様々な解析を行った結果、全長にわたって天然変性しているような変なタンパク質群がアルゴノートを保護して安定化していること、またアルゴノートに限らず様々なタンパク質をストレスによる変性などから守る効果があることを見出しました。その結果はbioRxivで公開しています(https://www.biorxiv.org/content/10.1101/816124v1)※。
※取材時(2019年11月)はプレプリントで公開:2020年3月、PLOS Biology誌に掲載
(https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3000632)
-プレプリントではHero(heat-resistant obscure)タンパク質とよんでいますね。
プレプリントではHero(ヒーロー)ですが、天然変性タンパク質でヘロヘロしたようなものなので、私たちは「ヘロヘロくん」とよんできました(笑)。なにしろ構造をとらないし、配列も保存されていないのですから。
Heroはタンパク質を安定化させるはたらきがあります。例えば、GFPをクロロホルム処理すると通常は失活しますが、Heroを加えると蛍光能が最大で9割程度維持されます。また、神経変性疾患ではTDP-43やPolyQなどの凝集が起こりますが、培養細胞でHeroを発現させるとそれらの凝集が強く抑制されます。ショウジョウバエの全身でHeroを過剰に発現させると寿命が延びることもわかりました。
-全然ヘロヘロしていないですね(笑)。Heroはどのようにタンパク質を安定化させているのですか?
Heroがはたらくメカニズムはまだまだよくわかりませんが、TDP-43の凝集抑制に限って言えば、Heroのアミノ酸配列そのものよりも、チャージ(電荷)や全体の長さといった、「ポリマー」としての性質が大事であることがわかってきました。安定化させられるタンパク質のまわりにHeroがまとわりついたり、タンパク質の間に割り込んだりして凝集を防いでいるのかもしれません。いわば、天然のポリエチレングリコール(PEG)のようなものではないかと考えています。
-このようなHeroは何種類くらいあるのですか?
候補としては数百種類あると考えています。今回はデータベースから天然変性スコアが高く、様々な細胞で強く発現して等電点が偏っている6種類に限定して解析しましたが、おそらく生体内ではある程度の冗長性を持って複雑に機能していると考えています。従来からクマムシや植物の種子など、極限環境で生きる生物でこのような天然変性タンパク質が存在することはわかっていたのですが、ヒトも含めてごくありふれた生物にも存在し、重要なはたらきを担っていることが驚きであり、面白いところです。氷山の一角が見え始めたところだと思っています。
生化学の強みを活かし続ける
-今後、研究室としてはHeroに比重を置くのですか?
そこは少し悩んでいるところです。私たちの強みはやはりRNAであり、ノウハウや知見の積み重ね、ここでしかできない実験を活かそうと考えています。一方、材料がRNAであれタンパク質であれ、生体内で起きている複雑でよくわからない現象をうまく抽出して、その原理を徹底的に知りたいというのが私たちの大きなモチベーションです。ですので、研究室の名前が「RNA機能研究分野」ということには特にこだわらず、Heroも含めた新しい方向性を常に模索して行ければと考えています。
-小分子RNAもHeroも医療への応用が期待できそうですが、そのあたりについてはどう考えていますか?
私たちは、普遍的かつ基礎的なメカニズムを解明することに力を注いでおり、医学や応用的な研究には、自分たち自身ではあえて踏み込まないように心がけています。一方、私たちが見出した知見を応用して、医療などにつなげていただけるのであれば、それはとてもうれしいことですし、ぜひ専門家にお任せできればありがたいと考えています。どちらも重要なアプローチで、どちらか一方が欠けていてはいけませんが、そこは役割分担を明確にして、それぞれが得意なことをうまく組み合わせ、人類全体として課題を解決できればいいと思います。
その中で私たちは、やはり昔ながらの生化学にこだわりたいと考えています。手間も労力もかかり、系を確立するだけで1年以上かかることもよくありますが、試験管内再現そして責任因子の単離と再構成という昔ながらの泥臭い努力を積み重ねてきたからこそ、そこに何か足りないものとしてのHeroの存在に気づくことができたのだと思います。生化学の強みを今後も大切にしていきたいですね。
<プロフィール>
泊 幸秀(とまり ゆきひで)
東京大学定量生命科学研究所教授・副所長
東京大学新領域創成科学研究科メディカル情報生命専攻教授1975年生。2003年東京大学大学院工学系研究科化学生命工学専攻博士課程を修了(上田卓也教授)。博士(工学)。米国マサチューセッツ州立大学博士研究員(Phillip Zamore教授)を経て、2006年、東京大学分子細胞生物学研究所講師。2009年同准教授、2013年同教授。また2017年より同副所長を務める。改組に伴い、2018年より東京大学定量生命科学研究所教授・副所長。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




