<研究最前線>胡桃坂仁志-DNA収納様式から遺伝子発現制御を明らかにする

東京大学定量生命科学研究所教授の胡桃坂仁志先生は、DNAの核内収納様式である「クロマチン構造」に注目し、遺伝子発現を制御する仕組みを解明しようとしています。クロマチン構造や解析方法、ERATOとして採択された野心的なプロジェクト「胡桃坂クロマチンアトラスプロジェクト」などについてお話を伺いました。
遺伝子のオン・オフを担うもの
-現在の研究テーマを教えてください。
DNAとタンパク質の複合体である「クロマチン」の構造を解析し、細胞内で遺伝子の機能を制御する仕組みを明らかにすることです。
生命を決定する”設計図”ともいえる遺伝情報を担う物質が何かということについては、1943年にオズワルド・アベリー、1952年にアルフレッド・ハーシーとマーサ・チェイスが行った実験により、遺伝物質はDNAであることが明らかになりました。翌年にはジェームズ・ワトソンとフランシス・クリックが、DNAは2重らせん構造をとると発表しました。
それから数十年間、DNAに書き込まれている情報が生命を決定しているという認識は当たり前になりましたが、みんなが気づいていたけれども知らんぷりしていた大問題が1つあります。
-それは何でしょうか?
私たちは、元々は受精卵という1個の細胞ですよね。それが分裂を繰り返していくうちに、ある細胞は皮膚になり、ある細胞は脳を作るというように、違いが生じます。おかしいでしょう?
かつては、皮膚になる細胞は次第に皮膚に必要な遺伝子以外は捨てて皮膚に特化した細胞になる、ということも考えられていました。しかし、ジョン・ガードンがカエルの細胞の核を受精卵に移植してクローンカエルを作り、さらに1990年代には羊の乳腺細胞の核からクローン羊のドリーが誕生したことで、遺伝子は捨てられるという説は否定されました。
実際には、どの細胞もすべての遺伝子を持っていて、スイッチをオン・オフにするかのように使い分けているのです。では、どうやってオン・オフを切り替えているのか。そこで注目されているのがクロマチンの構造です。
-クロマチンとはどのようなものですか?
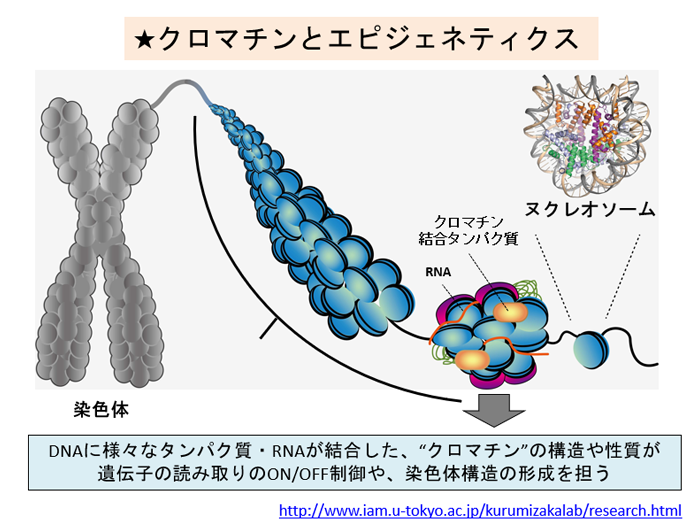
細胞の核内では、DNAはヒストンというタンパク質に巻きついており、この状態をヌクレオソームといいます。ヌクレオソームを基本単位として、高次構造の形で細胞に収納されているものがクロマチンです。
このクロマチン構造の違い、つまりDNAの折りたたまれ方の違いこそが遺伝子のオン・オフの決定に重要な意味を持つのです。しかし、具体的にどのような構造をとってどのように遺伝子発現を制御しているのか、明らかになっていません。
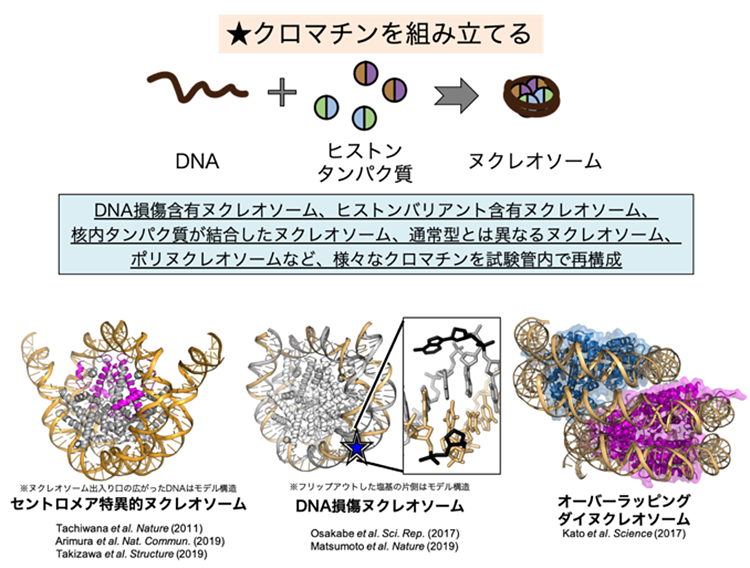
生体内では、クロマチン構造は様々な状態をとります。「折りたたまれ方の違いがどのようにできるのか」の前に、「どういう形で折りたたまれているのか」を知らないといけません。我々の研究室では、試験管内で均一なクロマチン構造を再構成し、その立体構造や生化学的性質を解析することで、クロマチンのメカニズムを解明しようとしています。
40年以上の謎を解明
-どのようにしてクロマチン構造を見るのですか?
以前はX線結晶構造解析を用いていました。この手法では、ヌクレオソームを結晶化したものにX線を照射し、得られる回折像から構造を決定します。我々はヌクレオソームのX線構造を100個近く解析してきました。
ところが、X線での解析で使えるDNAの配列はせいぜい2種類なのです。それ以外を使うと結晶化がうまくいかないのです。DNAの構造が違う、言い換えればDNAの運動性が高くなると結晶にならないのですが、DNAの運動性が違うからこそクロマチンの折りたたまれ方が違うはずです。これが見たいのです。つまりクロマチンの折りたたまれ方の多様性が見えないX線結晶構造解析では、我々が本当に知りたい遺伝子発現のオン・オフについて議論できないのです。
-では、どうされたのですか?
クライオ電子顕微鏡を使うようになっています。タンパク質などを特殊な溶液中で急速凍結することで、分子構造を壊すことなく生きた状態のまま、実際に目に見えるものとして観察できます。X線結晶構造解析では不可能であった、多様なヌクレオソーム構造の観察ができます。
X線での解析に限界を感じ始めていたころ、うちの研究室の卒業生で今は助教を務めている滝沢由政さんが所属していた沖縄科学技術大学院大学(OIST)に、導入されたばかりの最先端のクライオ電子顕微鏡があり、彼をつてにして使わせていただきました。おかげさまで、クライオ電子顕微鏡によるクロマチン構造解析を世界でも初期のころに発表できました。今では東京大学に同クラスのクライオ電子顕微鏡が導入され、クライオ電子顕微鏡でクロマチン構造解析を行う、世界的な第一人者の研究室の一つにカウントされています。
-最近の成果について教えてください。
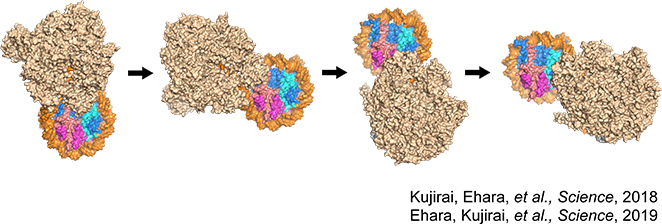
理化学研究所生命機能科学研究センター転写制御構造生物学研究チームのチームリーダーである関根俊一先生と共同研究したもので、ヒストンに巻きついたDNAをRNAポリメラーゼIIがどう読み取っているのかを明らかにしました。RNAポリメラーゼIIはDNAからRNAに転写する酵素です。RNAポリメラーゼIIの立体構造は2000年に明らかになったのですが、実際にどうやってヌクレオソーム中でヒストンからDNAを剥がしているのかについては、ヌクレオソームが発見されて以来40年以上もの間ずっと謎でした。
我々は、RNAポリメラーゼIIがヌクレオソームのDNAをRNAへ転写している最中の複合体を試験管内で再構成し、各ステップをクライオ電子顕微鏡を用いてスナップショットのように撮影しました。その内容は『Science』に掲載されました。
(https://science.sciencemag.org/content/362/6414/595)
RNAポリメラーゼIIはヒストンの外周を回るように、DNAを20塩基対、50塩基対、60塩基対と段階的にヒストンからDNAを剥がしながらRNAを合成する。
-ジャーナル編集部とのやり取りはどうでしたか?
投稿して審査され、修正稿を送ったのち1週間でアクセプトでした。しかも、Protein Data Bankに登録したヌクレオソーム・RNAポリメラーゼIIの立体構造データは、通例では論文の掲載から1〜2週間後に公開されるのですが、このときは掲載前日に公開されました。僕らもびっくりしましたし、Twitterでも「すごいのが出ている!」と騒然。翌日に掲載された論文はその日のうちにすごい数のアクセスがあり、オルトメトリクスは100を超えました。私の人生の中で一番のヒット作です。
それを記念して『Go around!』という曲を作り、YouTubeで配信しました(笑)。
胡桃坂クロマチンアトラスプロジェクト
-2019年10月には、JSTの戦略的創造研究推進事業 総括実施型研究(ERATO)の「胡桃坂クロマチンアトラスプロジェクト」が始動しました。どのようなプロジェクトでしょうか?
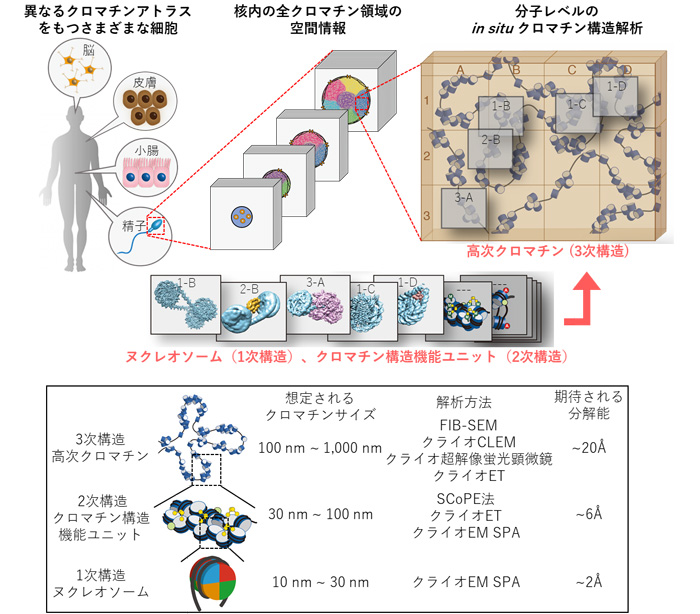
最初にお話ししたように、受精卵からの発生・分化においては、DNAの塩基配列も重要ですが、クロマチン構造こそが生物を決定する最重要ファクターであると考えています。
そこで、クロマチンの折りたたまれ方の立体構造地図を「クロマチンアトラス」と定義して、まずはクロマチンアトラスの解析ができるシステムの構築から始めます。
-具体的な方法を教えてください。
実際に細胞核をスライスして核内のクロマチン構造内の折りたたみを、クライオ電子顕微鏡をのぞいて可視化できるシステムを作ろう、というものです。野心的なプロジェクトですよ。そのために、ERATOの予算で新しくクライオ電子顕微鏡を購入することになりました。
現在、最高スペックのクライオ電子顕微鏡を国内で保有しているのはOIST、大阪大学、東京大学で、それぞれ1台ずつです。しかし同機種は、アメリカでは100台近く、ヨーロッパ全土では数十台、中国でも30〜40台くらい導入されています。日本はクライオ電子顕微鏡の分野で遅れており、その整備は急務です。今回のプロジェクトを機に、国内でのクライオ電子顕微鏡の技術開発も必要だと考えています。
研究のきっかけは憧れ
-胡桃坂先生がクロマチン研究を始めるきっかけは何だったのですか?
そもそも子どものころから目指していたのは、研究者ではなくミュージシャンでした。大学に進学したのも、親から「音楽専門学校ではなくて大学なら生活費を出す」と言われ、とにかく出身地の名古屋から東京に出たくて東京薬科大学(東京都八王子市)に進みました。大学院に進んだのも、研究をしたいからではなくて就職せずに音楽を続けたかっただけです。
でも、さすがに大学院生にもなると、音楽で食べていける見込みが薄れてきました。当時は大学のある八王子という環境のせいにしていましたが、東京薬科大学の後輩にあたるケツメイシはメジャーデビューし、FUNKY MONKEY BABYSは八王子出身だし、環境のせいではなくて単純に自分のやり方が悪かっただけですね(笑)。
-そこから研究の道に進んだ理由は?
夢を失いかけて途方に暮れていた修士課程のころ、アラバマ大学に留学していた研究室の先輩(現在は明星大学教授で副学長を務めている清水光弘先生)が一時帰国した折のセミナーを聴いたのですが、青い空と緑の木々がいっぱいのアメリカの写真を見せつけられて、「こんなところで研究をしています」という言葉がすごくかっこよく聞こえました。博士号を取ればアメリカに行けると知って、それで博士課程に進もうと決めました。
先輩はその後、アメリカ国立衛生研究所(NIH)でクロマチンの研究をしてから東京薬科大学に戻ってきて、そこで初めてヌクレオソームやヒストンなどを教えてもらいました。先輩への憧れもあって、「これからはクロマチンだ」と思ったのはそのときです。
そして、当時埼玉大学の客員教授でいらした理化学研究所の柴田武彦先生のもとでバクテリアのDNA組み換えの研究で博士号を取得し、イェール大学に留学後、NIHのアラン・P・ウォルフのもとでクロマチン研究を始めたのが1995年です。ここが私のクロマチン研究の始まりです。
-かなりの紆余曲折があったのですね。
クロマチンに興味を持ったというよりも、先輩がかっこよく見えたのが大きなきっかけです。同じ大学出身なのにアメリカで研究をしているのがすごい、という憧れがありましたから。そういう憧れの人がいると違いますよね。
だから、自分もそういう存在になれたら、と考えています。学生に「胡桃坂先生でもここまで来られたのだから、自分たちも大丈夫」と思ってもらう状況がいいかな、と。私も学生に「君たちなら大丈夫だよ、最低でも俺みたいにはなれる」と言っています。ただこのごろは、「最低でもERATOに採択されるよ」とは言えないのでちょっと困っていますけどね(笑)。
<プロフィール>
胡桃坂仁志(くるみざかひとし)
東京大学定量生命科学研究所 教授
1967年生。1989年 東京薬科大学薬学部卒業。1995年 埼玉大学大学院理工学研究科修了(柴田武彦客員教授、理化学研究所) 博士(学術)。1995-1997年 米国 National Institutes of Health 博士研究員。1997-2003年 理化学研究所 研究員。2003-2008年 早稲田大学理工学部 助教授を経て先進理工学部准教授。2008年 早稲田大学先進理工学部 教授(2018年から名誉教授)。2018年から現職。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須