<研究最前線>濡木理-生体分子の構造解析から昔願った生きがいを見出す

東京大学大学院理学系研究科教授の濡木理先生は、主に膜タンパク質や非翻訳RNA結合タンパク質を原子分解能レベルで観察し、その構造解析から生命現象を理解することを目的に研究をされています。最近の研究成果や面白さ、そして論文がアクセプトされるための心構えなどについて、お話を伺いました。
構造生物学者として「本当に薬を作ってやろうじゃないか」
-現在の研究テーマを教えてください。
主に2つあり、膜タンパク質の構造機能相関の解析と、非翻訳RNAの機能について研究を行っています。
-膜タンパク質とはどのようなものですか?
膜タンパク質とは、細胞膜に埋め込まれているタンパク質のことで、生命活動において重要な機能を担っています。特に私が興味を持っているのは、チャネルやポンプ、トランスポーターとよばれる、イオンや物質を細胞内外に輸送する膜タンパク質です。これらには不思議なことに、光や音、温度、電場など、物理的な接触がなくても構造変化を起こして物質を細胞内外に輸送できるものがあります。どのような仕組みがあるのか、わかっていないことが多くあります。
また、シグナル伝達に関わる受容体、中でもGタンパク質共役受容体(GPCR)には、味覚分子や嗅覚分子と結合する味覚受容体や嗅覚受容体がありますが、そのほとんどの構造がわかっておらず、味や匂いをどう伝えるのかというメカニズムもわかっていません。そこを明らかにしたいですね。
-膜タンパク質の構造機能相関の解析とは何でしょうか?
私たちの研究室では、X線結晶構造解析やクライオ電子顕微鏡などでタンパク質の立体構造を決定し、そこから得られる情報をもとにメカニズムについての仮説を立て、in vitroおよびin vivoで機能解析を行い、仮説を検証することを行っています。
-どこに研究の面白さを感じますか?
膜タンパク質が物理刺激や化学刺激に惹起されて構造変化を起こし、それによって物質を輸送したりシグナルを伝達したりする基礎的なメカニズムが面白いと思っています。
それだけでなく、神経系のGPCRと薬との複合体の構造解析などでは、創薬に結びつくような発見もあります。構造生物学者がよく研究費の申請書などで「創薬につなげる」と言っておきながらなかなか薬ができないことに歯がゆい感じを覚えていますが、私には「本当に薬を作ってやろうじゃないか」という気持ちがあります。
-膜タンパク質の構造解析には難しい印象があるのですが。
そこまで難しい印象は持っていません。例えば私たちは、GFPタグを利用したFluorescence-detection Size-Exclusion Chromatography(FSEC)という方法を使っています。この方法は、GFPでタグづけした膜画分を可溶化したままでゲルろ過クロマトグラフィーを行い、GFP蛍光を目印にピークの形状などを見ると、構造解析に向くかどうか評価できるものです。うちの研究室にはFSEC用の実験機器が5台あり、1台で1日あたり10サンプルくらい実験できます。つまり1日で50サンプルの発現系を検討でき、1日でどの発現系が適しているかだいたいわかります。あとはX線なりクライオ電子顕微鏡なりで解析するだけです。可溶性タンパク質より簡単ではないか、という気もしています。技術は必要ですが。
-最近ではどのような発見をされましたか?
10回膜貫通タンパク質であるP4-ATPアーゼの立体構造の解析です(https://science.sciencemag.org/content/early/2019/08/14/science.aay3353)。細胞膜はリン脂質二重層を形成していますが、外側と内側とでは組成が異なっており、このことは様々な生体反応に関与します。例えばホスファチジルセリン(PS)は、細胞の外側にあるとファゴソームという小胞に取り込まれ、いわゆる“eat me”シグナルが発生して細胞が食べられてしまうので、通常は細胞の内側にひっくり返して隠しています。そのひっくり返す酵素がP4-ATPアーゼであり、フリッパーゼとよばれています。
私たちはクライオ電子顕微鏡を用いて、P4-ATPアーゼがATPを使いながらPSをひっくり返すときの6つの中間状態の構造を明らかにすることで、PSの輸送機構を解明しました。
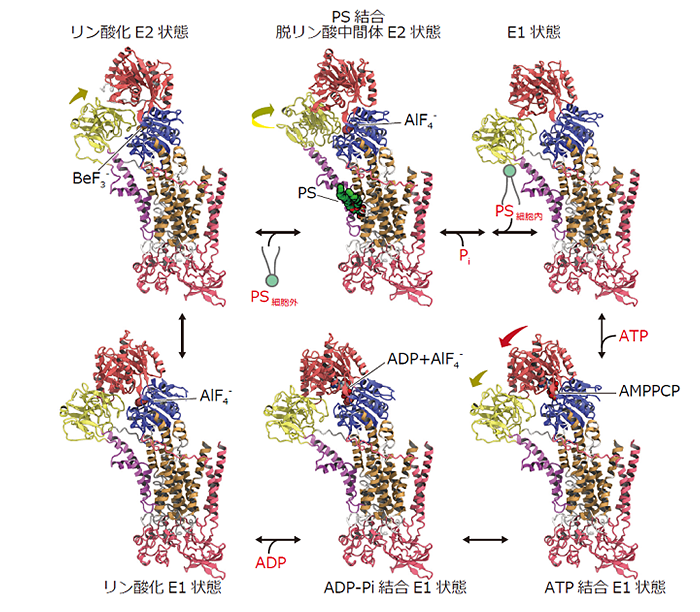
-構造解析にはどれくらいの時間がかかったのですか?
3週間くらいで構造が解けました。昨年、東京大学にクライオ電子顕微鏡が導入されてから、私たちのグループだけで20種類以上の構造が新たに解析されました。そのほとんどは膜タンパク質です。
-クライオ電子顕微鏡は強力ですね。
それと関連して、2019年8月にクライオ電子顕微鏡による構造解析を受注するベンチャー企業「キュライオ」を立ち上げました。製薬会社などから依頼を受けるのですが、ジョイントベンチャーとして創薬も考えています。従来の薬は競合的阻害薬が主だったのですが、キュライオでは新しいアプローチとしてアロステリック阻害薬を目指しています。
全く新しいゲノム編集ツールの開発へ
-もう一つの研究テーマである非翻訳RNAについて教えてください。
RNAからタンパク質が作られることを翻訳と言いますが、全ゲノムの約7割がRNAに転写されていながら、そのほとんどがタンパク質に翻訳されず、独自の機能を持っていると考えられています。このようなRNAは非翻訳RNA(ncRNA)とよばれています。私が最初に研究室に入ったときの研究テーマが、ncRNAの一つであるtRNAに作用するアミノアシルtRNA合成酵素の結晶構造解析でした。そのころからずっとncRNAに興味がありました。
-最近ではどのような研究成果が得られましたか?
2014年度にAMEDの革新的バイオ医薬品創出基盤技術開発事業「新規CRISPR-Cas9システムセットの開発とその医療応用」に採択され、ゲノム編集の中でも非翻訳RNAが使われるCRISPR-Cas9でガイド鎖RNAと標的DNA、DNA切断酵素であるCas9の複合体の結晶構造を世界で初めて解明しました。
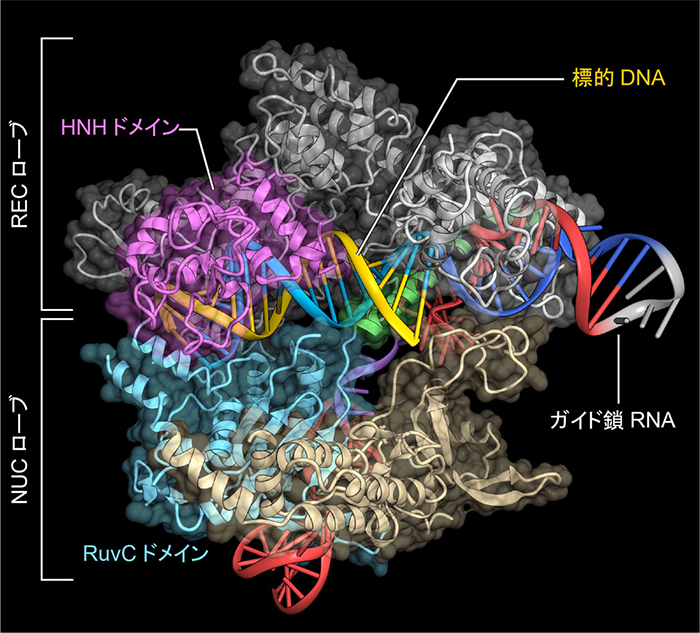
-この発見はどのように応用されるのですか?
立体構造に基づいて改変し、新しいゲノム編集ツールを作ることが可能になりました。例えばCRISPR-Cas9では、標的のDNA配列の近くにPAM配列とよばれる特定の塩基配列がないと配列を認識できません。つまり適用制限があります。しかしCas9の構造と機能がわかった今、PAMが短くても済む、あるいは不要となるようにCas9を合理的に改変できるようになったのです。
また、Casではない、全く新しいゲノム編集のツールを作ることができるかもしれません。CRISPR-Cas9は特許の問題があって企業が手を出しにくくなっていますが、もし私たちの手で新規ゲノム編集ツールを作ることができれば、日本の企業はある程度アプローチしやすくなると思います。非常にインパクトは大きいでしょう。
-濡木先生が共同創業者であるゲノム編集のベンチャー企業「エディジーン(現:モダリス)」について教えてください。
採択されたAMEDの事業のゴールに「ベンチャー企業を立ち上げる」という条件があったのです。ビジネスから一番遠い人間である私には無理だろうと思っていたのですが、経営コンサルタントの森田晴彦さん(現CEO)が私のセミナーを聴きに来てくれたのが縁で、2016年に一緒に立ち上げることになりました。
Cas9の構造解析から得られた知見を生かして、特にゲノム編集を用いた筋肉や神経の希少疾患の治療を目指しています。ヒトを対象とした試験に至るのも時間の問題であると考えています。
-希少疾患の治療につながるといいですね。
実を言うと、高校生のときに医者になりたいと考えたころがありました。何か人の役に立ったら、自分が生きている実感が得られると考えたからです。ところが、父に猛反対されました。「医者は技術者である」と。医者は、一瞬一瞬では目の前の一人しか助けることができないけれど、研究者ならその一瞬で何百万もの人を助けることができる、というわけで基礎研究の道に進みました。血を見るのが怖かったこともあるのですが(笑)。
しかし今では、膜タンパク質もncRNAの研究も医学につながっているところがあり、昔願った生きがいを見出していると感じています。
エディターに直談判
-大学教員とベンチャー企業の取締役と、二足のわらじは大変ではありませんか?
大学で授業を持って、いい学生を研究室に引き込むことは大事だと思っています。教科書の内容だけでなく研究の醍醐味などアドバンスな講義をすると、興味を持ってラボに訪ねてくる学生もいます。また、母校の私立武蔵高校で授業をしたこともあるのですが、その授業を受けた高校生がうちの研究室に入って博士号を取得し、今はドイツに留学しています。リクルートではないですけど、こういうことがあるとやりがいを感じますね。
-研究者であり、起業家であり、営業マンでもあると(笑)。
そうかもしれませんね(笑)。
-濡木先生の論文は常にレベルの高いジャーナルに掲載され続けていますが、何か秘訣や心意気はありますか?
私もリジェクトされたり、競争に負けたりすることはしょっちゅうあります。でも一つ言えるのは、エディターに掛け合うくらいの粘りは大事です。海外の研究者はリジェクトされてもエディターと電話で掛け合うことが多いのですが、私も経験があります。
以前、ある海外の研究グループと共同で『nature』に投稿しようと約束していたのに抜け駆けされたことがあります。そのときは怒ってエディターに電話をかけて、「うちにはこういうデータがある」と主張して、アクセプトになったのです。
また、カルシウムトランスポーターの解析について、海外の競争相手が2週間後に『nature』に論文を載せることがわかったとき、『Science』のエディターに電話して、「うちもこういうふうにアピールできるから2週間でなんとかしてくれ」とお願いしました。最初にサマリーや図の動画を作って送り、それは本当に2週間で通してくれました。
リジェクトされても「これは通ってもいいんじゃないか」「これはおかしいんじゃないか」と思ったら諦めずに粘るのです。そうしているうちに、私たちオーサーとエディターとの間に信頼関係のようなものが出てきます。
-エディターも人間ですから、熱意で心を動かされるところがあるのかもしれないですね。
エディターはいろんな学会に参加しているので、そこで「やっと会えましたね」みたいな感じで、そこでもまたリバイス中の論文について話せるようになります。
なので、私はそういう機会を作りたいと考えています。日本で国際学会をやるときには、なるべくエディターをよぶようにしています。エディターに直に会ったり、せめて電話で話したりする勇気を持つことが日本の研究者にはもう少し必要かな、と思います。
<プロフィール>
濡木理(ぬれきおさむ)
東京大学大学院理学系研究科 生物科学専攻 教授
1965年生。1993年 東京大学 大学院理学系研究科 博士課程 修了(横山茂之教授)。1992-1993年 日本学術振興会 特別研究員(DC2)。1993-1994年 日本学術振興会 特別研究員(PD)(横山茂之教授/東京大学)。1994年 理化学研究所基礎科学特別研究員(岩崎準 主任研究員/結晶学研究室)、1995年 東京大学大学院理学系研究科 助手、2002年 東京大学大学院理学系研究科 助教授、2003年 東京工業大学大学院生命理工学研究科 教授、2008年 東京大学医科学研究所教授、2010年より現職。2002-2007年 独立行政法人 科学技術振興機構(JST)さきがけ 個人研究者兼務。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




