アポトーシス(apoptosis)とは?ネクローシスとの違いも徹底解説
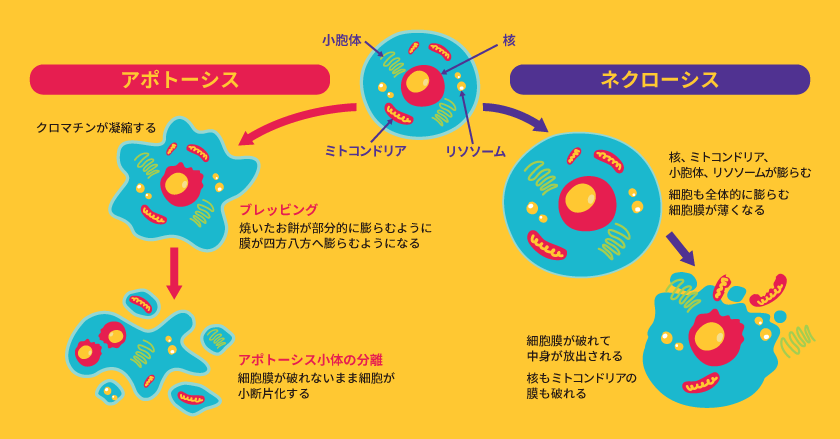
細胞死とは、機能不全に陥った細胞が死ぬことだけを意味するものではありません。生命活動においては、しばしば能動的な遺伝子発現による計画的な細胞死「プログラム細胞死(programmed cell death: PCD)」が起きています。
プログラム細胞死の中でも有名なものが「アポトーシス」です。本記事では、アポトーシスの概要や特徴、細胞死の一つであるネクローシスとの違い、そしてアポトーシスの研究手法について解説します。
アポトーシスの例と役割
アポトーシスは、発生学における形態形成分野で詳しく研究されてきました。
脊椎動物の肢の形成では、線維芽細胞増殖因子(fibroblast growth factor: FGF)を放出する細胞群と、FGFに応答してソニック・ヘッジホッグ(sonic hedgehog: SHH)を放出する細胞群が必要ですが、FGFとSHHを放出した細胞はアポトーシスにより失われることが知られています*1。
FGFやSHHなどのモルフォゲン(濃度依存的に細胞分化に関わる分子)を放出する組織の一部が、細胞死によって速やかに失われることで、形態形成が時空間的にコントロールされています。
別の有名な例は神経管の閉鎖です。神経管とは、神経板の左右端が融合して形成される筒状の器官であり、脳や脊髄のもととなります。その際、アポトーシスが起きることは以前から知られていましたが、近年ではライブイメージングによる詳細な解析が可能となりました。
その結果、アポトーシスを阻害すると神経管閉鎖の速度が下がることがわかり、アポトーシスは円滑な神経管閉鎖に関わると考えられています*2。また、神経管閉鎖のアポトーシスでは、単に不要な細胞が取り除かれるだけでなく、取り除かれずに長時間とどまる死細胞の存在も明らかになりました*2。アポトーシスを起こした細胞が周囲の細胞の移動に寄与している可能性が考えられます。
また、アポトーシスは細胞数の減少だけでなく、細胞増殖にも関わっています。アフリカツメガエルでは、オタマジャクシのときに尾部を切断すると再生しますが、その際、アポトーシス阻害剤を添加すると再生しません*3。ヒドラの切断実験では、アポトーシスを起こした細胞から放出されるWnt3シグナルが周囲の細胞に対して増殖を促すことが報告されています*4。
このようにアポトーシスは単なる細胞死ではなく、発生や組織損傷に伴う再生に重要な役割をもつことが明らかになっています。
アポトーシスの分子機構
そもそも、アポトーシスとはどのような現象なのでしょうか。歴史的な観点から述べると、病理学で観察される壊死(ネクローシス)とは異なる形態の細胞死として見出されてきたのがアポトーシスです。
1972年、Kerrらはさまざまな組織の細胞死を詳細に観察した結果、ネクローシス(necrosis)の特殊な形態と考えられていた細胞死に対して、新たにアポトーシス(apoptosis)と命名しました。その特徴は、ブレッビング、クロマチンの濃縮、細胞の断片化などです(次項で詳述)。
ちなみにapoptosisという言葉は、「花びらが花から落ちる」や「葉が木から落ちる」というギリシャ語に由来し、細胞増殖に関わる有糸分裂(mitosis)と機能的に対比される概念です*5。
その後、1980年代になると、線虫(C. elegans)を用いた分子遺伝学的研究が盛んになりました。線虫は受精卵からの細胞系譜がすべて明らかになっており、発生過程で1090個の細胞が生まれ、そのうち131個が計画的に死ぬよう定められています。プログラム細胞死の研究にうってつけだったわけです。
特に、1986年に報告されたced-3遺伝子とそのクローニングは、その後のアポトーシス研究の発展に大きく貢献しました*6, *7。ced-3遺伝子こそが、アポトーシスで中心的な役割を果たすタンパク質分解酵素「カスパーゼ(Caspase)」をコードすることがわかったからです*7。
カスパーゼに加え、線虫で見つかった他のアポトーシス関連遺伝子も、哺乳類で保存されていることがわかりました。たとえば線虫のCed-4とCed-9は、それぞれ哺乳類ではカスパーゼ活性化タンパク質Apaf1、アポトーシス阻害タンパク質Bcl-2と相同性があります。
以下に、アポトーシスの分子機構を示します。
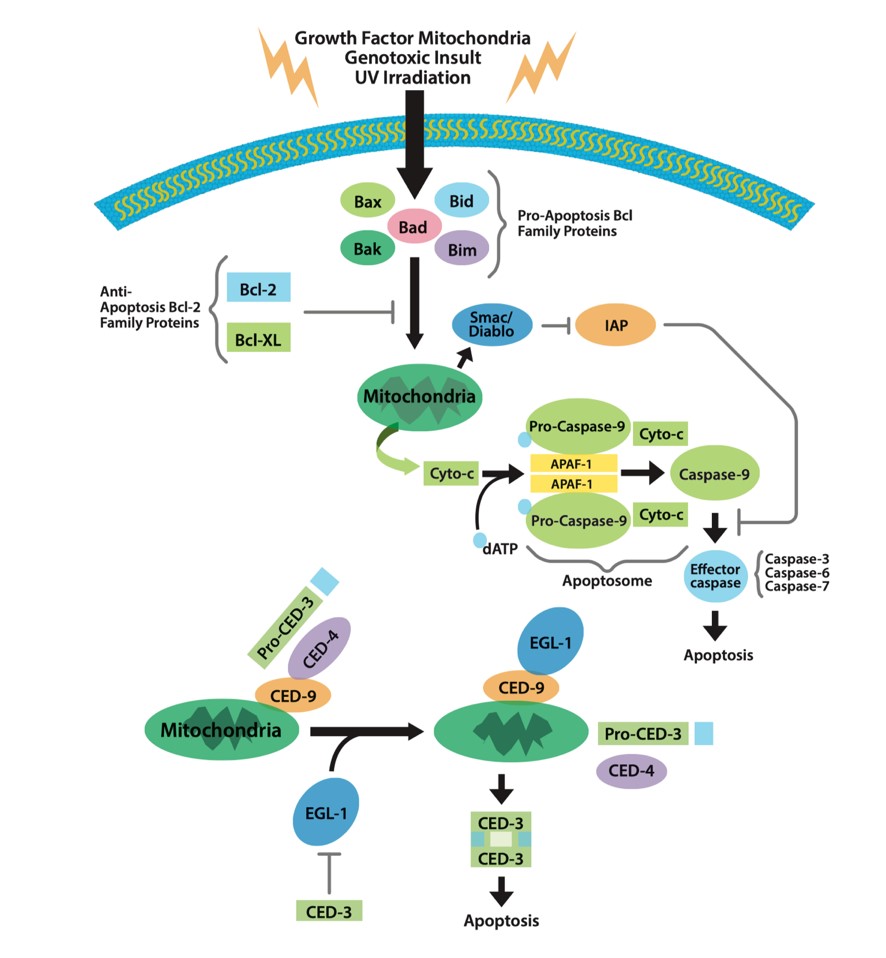
アポトーシスのシグナル伝達の全体像(上:哺乳類、下:線虫)
哺乳類のアポトーシスにおけるカスパーゼ活性化経路は、Fasや腫瘍壊死因子(tumor necrosis factor: TNF)レセプターなどによる刺激が引き金になります。Fasなどのリガンドがレセプターに結合すると、アポトーシス促進性タンパク質Bax、Bad、Bid、Bak、Bimが活性化します。これらのタンパク質にはBH3デスドメインがあり、アポトーシス阻害タンパク質Bcl-2やBcl-XLの機能を低下させることで、アポトーシスシグナルがミトコンドリアに伝達されます。ミトコンドリアからはシトクロムcが放出され、Apaf-1、Caspase-9と複合体(Apoptosome)を形成し、カスパーゼカスケードが開始されてアポトーシスが起こります。
アポトーシスとネクローシスの違い
アポトーシスが緻密な分子機構によって制御されているのに対して、ネクローシスは細胞が物理的・化学的に損傷したときに引き起こされる、偶発的で分子機序のない細胞死といえます。Kerrらが形態的な特徴からアポトーシスとネクローシスを分類したように、両者の形態変化には明確な違いがあります。
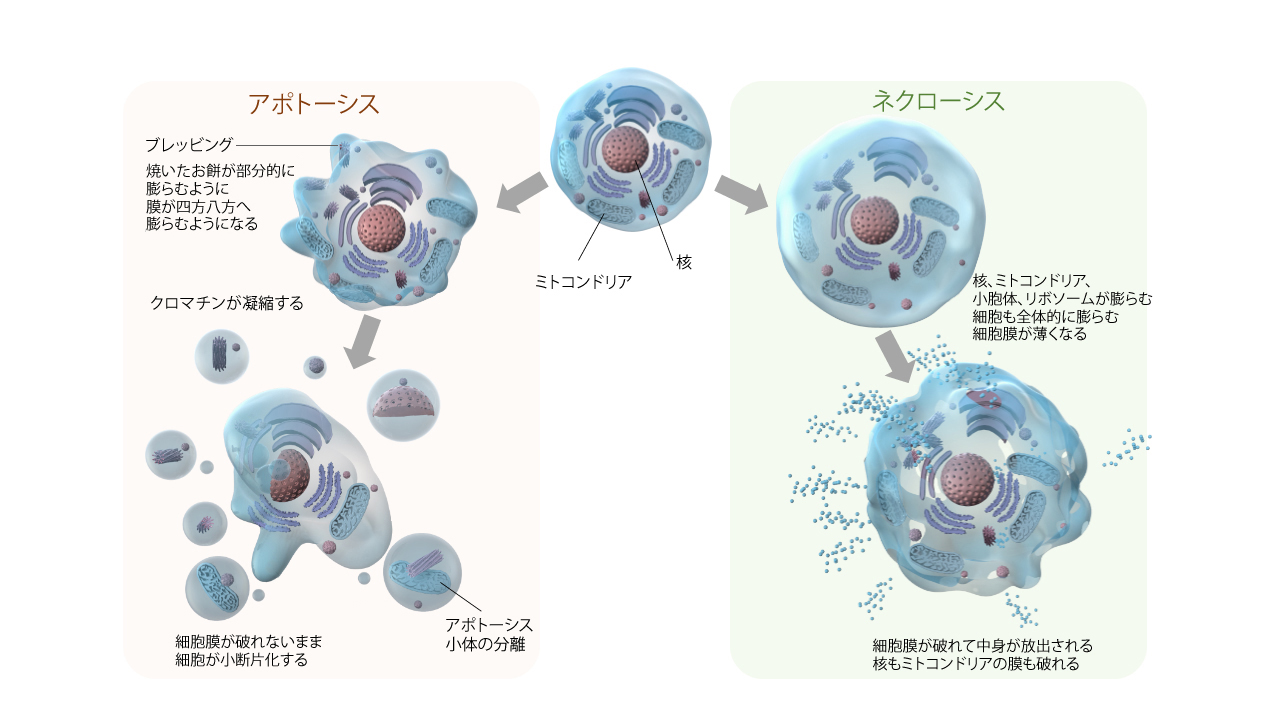
アポトーシスでは、細胞が四方八方に膨張して突起物を形成します(ブレッビング)。細胞質では細胞骨格の破壊が起き、核ではDNAの断片化と凝集が起こってクロマチンが濃縮されます。
やがて細胞も断片化され、複数のアポトーシス小体が形成されます。最終的に、アポトーシス小体がマクロファージに貪食されることで、細胞は消失します。
ネクローシスでは、細胞膜の選択的透過性が破綻することにより細胞が丸く膨潤し、細胞膜は薄くなります。核やミトコンドリアなどの細胞小器官も膨潤し、最終的には細胞膜が破裂して細胞の内容物が飛散します。
当初は、このように細胞破壊の形態からアポトーシスとネクローシスを分類して研究が進められたため、「プログラム細胞死とはアポトーシスのことであり、アポトーシス以外は非プログラム細胞死のネクローシス」と考えられてきました。
しかし、近年、ネクローシスのような細胞破裂型の細胞死でありながら、特定の分子によって制御されている細胞死があることも判明してきました。
ネクローシス様のプログラム細胞死には、RIPK3(receptor interacting protein 1 kinase)やMLKL(mixed lineage kinase domain-like)に依存するネクロトーシス(necroptosis)*8, 9、細胞死の際に炎症性カイトサインIL-1βを放出するパイロトーシス(pyroptosis)*10, 11などがあり、ホットな研究分野になっています。
アポトーシスの研究方法
アポトーシス研究では、アポトーシス特有の現象を検出することが重要になります。アポトーシス特有の現象の代表的な検出法には以下があります。
- 細胞膜の変化
正常な細胞では、細胞膜の外膜と内膜とではリン脂質の分布は非対称であり、リン脂質の一つであるフォスファチジルセリンは内膜のみに存在します。
ところが、アポトーシスを起こしている細胞では、外膜にフォスファチジルセリンが露出されます。露出されたフォスファチジルセリンは「eat me」シグナルとしてマクロファージによって認識され、貪食されます。
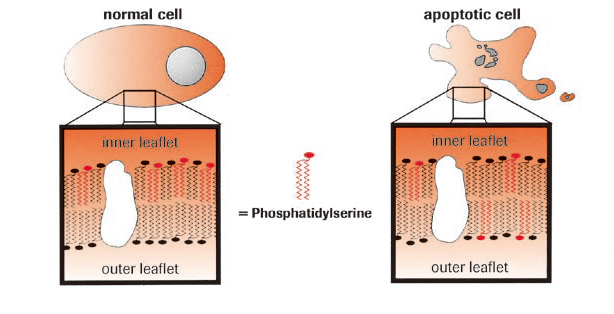
アポトーシスによるフォスファチジルセリンの外膜露出
(出典:細胞生存率測定キット・アポトーシス検出キットカタログ)
フォスファチジルセリンと高い親和性をもつタンパク質にAnnexin-Vがあります。ただし、Annexin-Vによるラベリングはアポトーシス細胞だけでなくネクローシス細胞もポジティブにしてしまうので、ネクローシス細胞のみを染色するヨウ化プロピジウムを併用することでアポトーシス細胞を検出できます。
- DNA断片化
アポトーシス進行中では、細胞質にヒストン複合型DNA断片が存在します。このDNA断片を電気泳動すると典型的なラダーパターンが見られるため、これをアポトーシスの指標とすることができます。細胞集団におけるアポトーシス解析で有効な方法です。
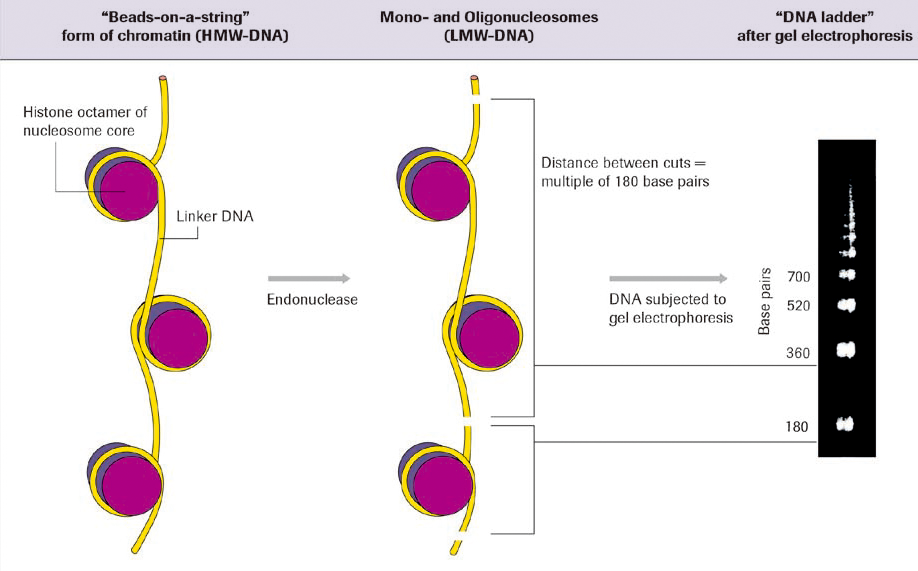
DNA断片化とDNAラダー出現の概要
(出典:細胞生存率測定キット・アポトーシス検出キットカタログ)
また、組織や単一細胞におけるアポトーシスの高感度検出ではTUNEL(Terminal deoxynucleotidyl transferase [TdT]-mediated dUTP Nick End Labeling)法という手法が用いられます。
アポトーシスの初期段階ではDNAのニックや、DNA断片化が起き、遊離3’-OH基が生じます。この3’末端を修飾ヌクレオチドでラベリングすることで断片化DNAを検出し、アポトーシスの指標にすることができます。
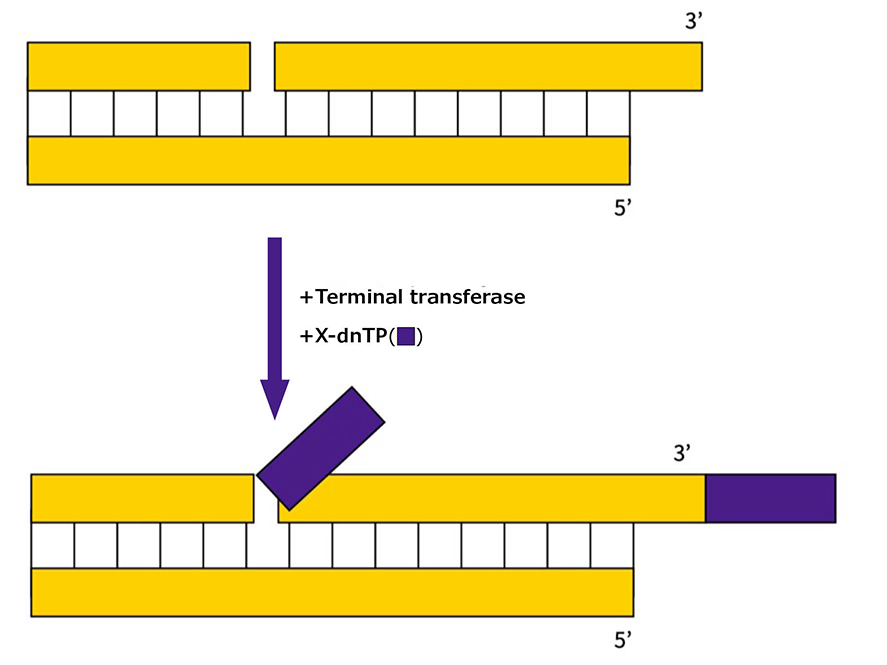
TUNEL法のスキーム
(出典:細胞生存率測定キット・アポトーシス検出キットカタログ、一部改変)
カタログのご案内
アポトーシス研究では、アポトーシス誘導剤や阻害剤を使うこともあります。上述したアポトーシス検出キットを含め、メルクではアポトーシス研究に必要な製品を多数用意しております。カタログもあわせてご覧ください。
その他、不明点やご意見、ご要望がありましたら、お気軽に下記のお問い合わせフォームよりご連絡ください。
参照元
*1 三浦正幸「プログラム細胞死:その分子機序と発生における生理的な役割」領域融合レビュー. 2012;1:e002
*2 Yamaguchi Y, Shinotsuka N, Nonomura K, et al. Live imaging of apoptosis in a novel transgenic mouse highlights its role in neural tube closure. J Cell Biol. 2011;195(6):1047-1060.
*3 Tseng AS, Adams DS, Qiu D, Koustubhan P, Levin M. Apoptosis is required during early stages of tail regeneration in Xenopus laevis. Dev Biol. 2007;301(1):62-69.
*4 Chera S, Ghila L, Dobretz K, et al. Apoptotic cells provide an unexpected source of Wnt3 signaling to drive hydra head regeneration. Dev Cell. 2009;17(2):279-289.
*5 Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer. 1972;26(4):239-257.
*6 Ellis HM, Horvitz HR. Genetic control of programmed cell death in the nematode C. elegans. Cell. 1986;44(6):817-829.
*7 Yuan J, Shaham S, Ledoux S, Ellis HM, Horvitz HR. The C. elegans cell death gene ced-3 encodes a protein similar to mammalian interleukin-1 beta-converting enzyme. Cell. 1993;75(4):641-652.
*8 Vanden Berghe T, Vanlangenakker N, Parthoens E, et al. Necroptosis, necrosis and secondary necrosis converge on similar cellular disintegration features. Cell Death Differ. 2010;17(6):922-930.
*9 Vanden Berghe T, Linkermann A, Jouan-Lanhouet S, et al. Regulated necrosis: the expanding network of non-apoptotic cell death pathways. Nat Rev Mol Cell Biol. 2014;15(2):135-147.
*10 Cookson BT, Brennan MA. Pro-inflammatory programmed cell death. Trends Microbiol. 2001;9(3):113-114.
*11 須田 貴司「パイロトーシスの分子機構と役割」(三浦正幸、清水重臣 編『細胞死 その分子機構,生理機能,病態制御』(化学同人)第10章)
細胞死全体については三浦正幸、清水重臣 編『細胞死 その分子機構,生理機能,病態制御』(化学同人)を参考にしました。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須