受容体の機能を知るための作動薬・拮抗薬の使い方

作動薬・拮抗薬の作用機序を知って正しい実験を
生体内に存在する受容体は、リガンドを認識して生体のさまざまな機能を誘導する重要な物質です。受容体の機能を調べるためには、受容体の働きを活性化する受容体作動薬や逆に働きを阻害する受容体拮抗薬がよく用いられます。薬理学実験には欠かせないこれらの薬剤ですが、適切に使えば有力な手掛かりを得られます。一方で、薬剤の使い方や解釈を誤ると、正しい結果にたどりつけなくなってしまいます。この記事では作動薬・拮抗薬を正しく理解するために、その種類と作用機序について解説します。
受容体作動薬の種類と働き
受容体と相互作用し、生物学的反応を誘発する分子を受容体作動薬と呼びます。ほとんどの場合、受容体作動薬は正の調節作用を有し、親和性と固有活性の両方を示します。また、作動薬は天然のリガンドの模倣物であり、天然のリガンドと同程度の生物学的作用を引き起こします。
受容体作動薬は結合部位への結合の強さによって、完全な反応、部分的な反応、弱い反応、逆の応答が起こります。そのような作用を引き起こす薬剤を、それぞれ完全作動薬、部分的作動薬、弱作動薬、逆作動薬と呼んでいます。
以下、各作動薬の作用を模式的に図1に示しました。作動薬と一口にいっても、効き方には大きな差があることがわかります。
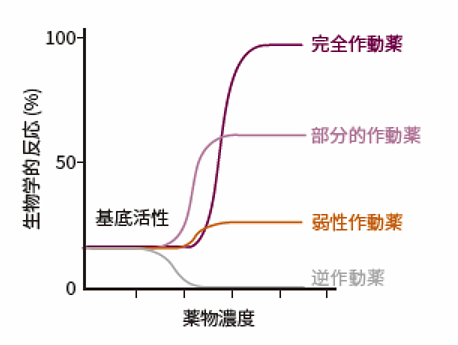
図1 完全、部分、弱性、及び逆作動薬の作用
それでは、それぞれの作動薬について解説していきます。
- 完全作動薬
完全作動薬は、受容体機能の活性化に高い効果を示します。例えば、イソプロテレノールは、β-アドレナリン受容体に対するアドレナリンの作用を模倣し、同程度の作用を引き起こします。
- 部分作動薬
部分作動薬は、受容体に結合はするものの、一部の反応しか誘導しません。そのため、ゆるやかな反応を起こしたいときに利用されます。よく知られる例が、オピオイド依存の治療に用いられるブプレノルフィンです。鎮痛剤として用いられるオピオイドは乱用すると依存症を引き起こしますが、ブプレノルフィンはオピオイド受容体に結合しオピオイドよりはマイルドに受容体を活性化します。そのため、オピオイドをブプレノルフィンに置換する治療が行われます。
部分作動薬が効果を発揮する分子メカニズムについては、まだ不明な点も多いですが、完全作動薬とは異なる受容体の立体構造変化を引き起こし、その結果、弱い薬理学的反応を生じると考えられています。中には受容体結合部位への親和性をほとんど下げずに、完全作動薬によって引き起こされた反応を競合的に阻害するケースも見られます。
- 逆作動薬
逆作動薬は、作動薬と同じ受容体結合部位に結合し、薬理学的反応を基底レベルの活性未満に低下させます。つまり、通常の作動薬とは反対の効果を生じさせるのです。後述する「受容体拮抗薬」との違いは、単に受容体の作用を遮断するのではなく、図1で表されているように反対の作用を及ぼすことです。受容体拮抗薬は受容体と結合し、作動薬を結合させないことによって活性を阻害しますが、作動薬がなくても常時活性化しているような受容体の活性は、拮抗薬で阻害することはできません。このような受容体の活動を減弱させるのに、逆作動薬は有効に働きます。
受容体拮抗薬の種類と働き
拮抗薬は受容体への親和性はありますが生物学的活性を持たないため、結合しても細胞機能を変化させませんが、結合サイトを占有するため、作動薬の効果を阻害します。このように受容体の結合サイトを遮断する拮抗薬は、受容体遮断薬とも呼ばれます。
拮抗薬は、作動薬との競合の仕方によって、競合的(可逆的)拮抗薬と非競合的(不可逆的)拮抗薬に分けられます。以下にそれぞれの特徴を解説します。
- 競合的(可逆的)拮抗薬
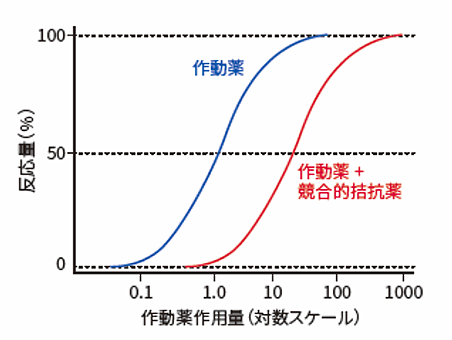
競合的拮抗薬は同一の結合部位を作動薬と取り合う(競合する)分子です。よって、作動薬の量を増やすと作動薬の結合量も増えるため、遮断作用を反転させることができます。逆に、高濃度の作動薬によってすべての受容体部位が占有されている場合は、さらに大量の拮抗薬を投与しないと受容体を遮断することができません。競合的拮抗薬を用いると、作動薬の作用量-反応曲線は平行に右側に移行しますが、最大反応は変化しません(図2)。受容体の活性レベルは、部位への各分子の相対的親和性と相対濃度によって決まります。

図2 競合的拮抗薬の作用
- 非競合的(不可逆的)拮抗薬
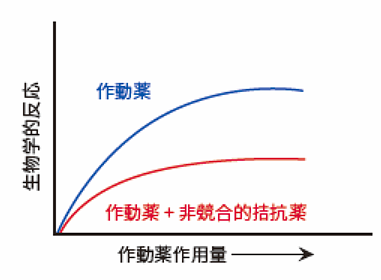
非競合的拮抗薬は、作動薬とは違う部位に結合して作用します。そのため、作動薬と結合部位を取り合うことはありません(非競合的)。結合は不可逆的であることが多く、結合親和性も高いため、短時間で多くの受容体を占有することができます。非競合的拮抗薬の多くは、受容体の活性化に必要な立体構造変化を防ぐことで受容体の活性を阻害しています。非競合的拮抗薬の例は、NMDAグルタミン酸受容体を不可逆的に遮断する(+)-MK 801マレイン酸です。
非競合的拮抗薬の作用持続時間は解離速度とは無関係で、受容体分子の回転率に依存します。また、非競合的拮抗薬を用いると、作動薬の作用量-反応曲線の最大反応量は低下します(図3)。図2との違いに注意してみてください。

図3 非競合的拮抗薬の作用
平衡解離定数(Kd)をマスターしよう
受容体とリガンドの作用を理解するためには、平衡解離定数(Kd)を正しく理解しておく必要があります。平衡解離定数は作用量-反応曲線から得ることができ、受容体(R)の50%がリガンド-受容体複合体(R-L)として占有されるときのリガンド(L)のモル濃度として定義されています。

Kdは化学的結合の尺度で、Kdが低いと結合親和性は高くなります。最大の効果の50%を生じる薬剤濃度EC50値とKdは、正確に相関している場合もありますが、受容体への結合様式によっては相関していない場合もあります。正確に実験をするためには、公表されているKdやEC50/IC50値に注意を払うか、実験によってこれらの値を決定することが重要です。
また、解離定数がピコ~ナノモル濃度の薬物は、解離定数がマイクロ~ミリモル濃度である薬物よりも強力に特定の受容体タンパク質に結合します。さらに、温度、pH、イオン強度などの溶液条件も、Kdに影響を及ぼします。データの誤った解釈を減らすためには、使用する特定の実験モデルに基づいて適切な投与濃度を選択しましょう。
作用量-反応曲線の定量化をするには
適切な薬物を選択して実験や治療に用いるためには、最大薬理効果や最大効力を判定する必要があります。薬物が薬理反応を起こす能力は、薬物-受容体の結合力、受容体の型又は亜型、拮抗薬の性質、作用量と受容体の下流シグナル伝達効果など、複数の要因に依存します。このため、適切に低分子を使用するには、作用量-反応曲線を実験的に確立する必要があります。これは、拮抗的な分子に対する反応が複雑で非線形であるためです。
作用量-反応曲線を作成するときは、薬物を広範な対数濃度で投与し、受容体や細胞、個体の反応を測定します。これらの反応曲線は次の式から得られます。Eは薬物作用(反応)、Emaxは最大反応、Cは薬物濃度です。
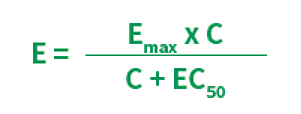
この式で表される反応は通常S字型になります(図4)。
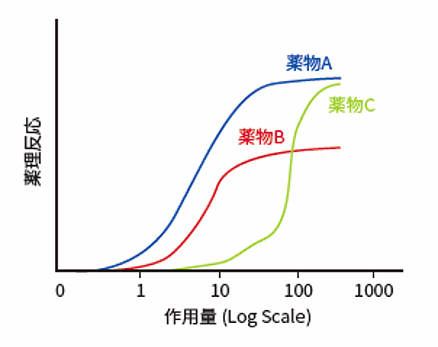
図4 薬物 - 反応曲線の比較
図4の薬物Aは投与当量あたり最も薬理活性を示す強力な薬物です。AとCは効力は異なっていますが最大有効性は同等です。BはCよりも強力ですが最大有効性は低い値を示します。治療目的で使用するためには、効力と有効性を区別することも重要です。分子の効力は、部分的には受容体に対する親和性に依存しています。有効性は、薬物分子が作用部位に到達する能力に依存しています。
ほとんどの薬物については、KdまたはEC50/IC50値が報告されているため、その有効性を正確に測定することができます。ただし、適切な投与量を正確に決定するためには、特定のモデル系に対して作用量-反応曲線を作成することが重要です。作用量-反応曲線を決定することで、低分子作動薬や拮抗薬の正しい濃度がわかります。また、ばらつきを制限し、データ解釈を助け、不要な繰り返しや研究中の動物の死亡を最小限に抑えることもできるでしょう。
作用量-反応曲線を作成した後は、最大または部分的な効果を生じさせるために実験に望ましい濃度を選択してEC50データを得ます。最大有効濃度は、通常は100%の効果に達する前に曲線が平坦になるように選択します。これによって、プロゾーン効果や副作用を引き起こす恐れがある不必要な過量投与を最小限に抑えることが可能です。薬物の効力が高いほど用量反応曲線は急勾配になり、過小または過剰投与の可能性が高まるということに留意しましょう。
以上、受容体の機能を調整する作動薬・拮抗薬について解説しました。これらを使うときは、薬剤の性質や作用機序をよく理解し、実験に適した試薬を選択して実験を成功させましょう。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須