クロマチン免疫沈降法と抗体の選び方

クロマチン免疫沈降法とは
クロマチン免疫沈降法(ChIP)は、染色体DNAに関連するタンパク質がin vivoでどのように分布しているのかをマッピングするため、従来から用いられている強力な技術です。この方法により、ヒストンサブユニット、転写因子、DNAに直接的または間接的に結合したその他の調節・構造タンパク質について調べることができます。
ChIPの成功には、染色体DNAの標的領域に関連するタンパク質を特異的に検出可能で、ChIPにおいて検証済みの高品質な抗体が必要となります。また、特定のDNA配列が対象のタンパク質と関連しているかどうかを確認するため、ChIPの後にはエンドポイントPCRおよび/または定量PCR(qPCR)を実施します。このような古典的なアプローチを用いることで、既知の標的遺伝子の数が限られていても、対象のタンパク質の相互作用を評価することができます。
ChIP実験は、主に以下のステップに分けることができます。
- サンプル調製
- タンパク質とDNAの架橋
- 細胞溶解およびクロマチンの断片化
- クロマチン免疫沈降法
- 洗浄、溶出および架橋の切断
- DNA精製またはクリーンナップ
- PCR解析
この記事では、このうちの「④クロマチン免疫沈降法」ついて詳しく解説します。
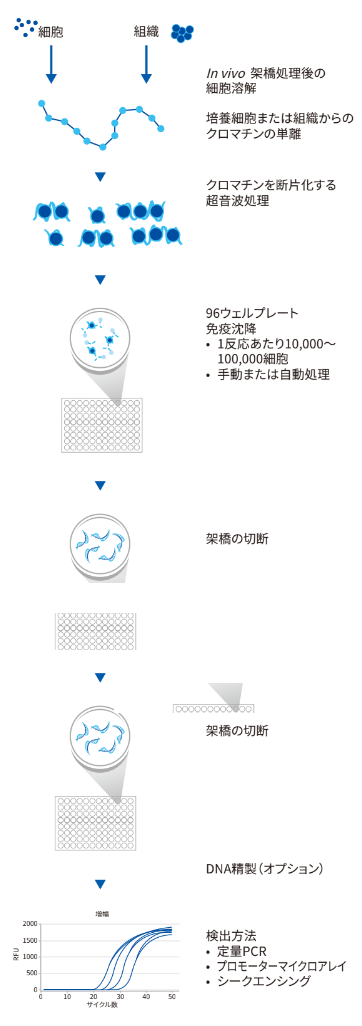
クロマチン免疫沈降法のワークフロー
クロマチン免疫沈降法における抗体の選択
このステップの目標は、調製されたクロマチン抽出液から、適切な抗体を用いて標的のタンパク質/DNA複合体を分離することです。
適切なChIP抗体の選択は、ChIP実験成功の鍵を握る最も重要なステップの1つです。通常のウェスタンブロットにおいて良好に機能する高品質な抗体であっても、ChIPには適さない可能性があります。変性したタンパク質を検出するウェスタンブロットとは異なり、ChIP抗体は非変性状態の標的タンパク質を認識するものでなければなりません。
最良の結果を生むChIP抗体は、特性の詳細が明らかで、標的タンパク質に結合することが実証されており、特異性について厳密に試験されている必要があります。したがって、実際にChIPにおいて検証済みの抗体(例:ChIPAb+TM検証済み抗体)以外は使用しない方が無難です。品質管理やChIPでの機能の実証が行われていない抗体を用いる場合は、実際のChIP実験用に抗体を1種類選択する前に、いくつかの抗体を評価することをおすすめします。
抗体を選択する際は、次の点を考慮します。
- モノクローナル抗体 vs. ポリクローナル抗体
- ChIPのコントロール抗体
- 特異性試験
- 検証試験
それでは、それぞれについて詳しく見ていきましょう。
モノクローナル抗体 vs. ポリクローナル抗体
モノクローナル抗体とポリクローナル抗体はいずれもChIPに用いることができます。
まず、モノクローナル抗体は、標的タンパク質における特定のエピトープを認識します。モノクローナル抗体は高度に特異的であり、非特異的結合の傾向が少ないという利点があります。また、クローンに由来する性能のばらつきが少ないため、バッチ間の再現性が高くなっています。
しかし、モノクローナル抗体によって認識されるエピトープが遮蔽されていたり、プロトコールの上流のステップで架橋などの変化が生じていたりする場合、そのモノクローナル抗体を用いて、標的タンパク質や関連するDNA配列を単離することはできません。ただし、経験的には、遮蔽がモノクローナル抗体の性能に影響を及ぼすことはほとんどないことが知られています。
対照的に、ポリクローナル抗体は、標的タンパク質の複数のエピトープを認識します。このため、仮にいくつかのエピトープが架橋によって遮蔽されていても、ポリクローナル抗体は有効である場合があります。しかし、ポリクローナル抗体は複数のエピトープを認識するため、非特異的結合が起こる可能性も高くなっています。
また、抗体の精製に用いる血清が調製や精製の前にプールされていない限り、ポリクローナル集団の特異性が、免疫化の間に経時的に変化する可能性がある点についても考慮することが重要です。同様に、市販されているほとんどのポリクローナル抗体は、バッチ間で性能が異なる可能性があります。ばらつきの程度は、販売業者の製造・品質管理基準によって異なります。
モノクローナル抗体またはポリクローナル抗体のいずれを選択するとしても、ChIPのために市販の抗体を選択する際には、十分なデータがある抗体が理想的です。すなわち、特異性を示すデータならびにChIPやその他の主要なアプリケーションにおける信頼性の高い成績を示すデータがある抗体です。
需要が高い抗体は、頻繁に再製造する必要があり、そのプロセスはホスト動物の免疫化から始まります。その結果、これらの抗体の特異性や親和性が、バッチによって異なる可能性があります。比較的大きなメルク規模の抗体製造業者では、複数の動物に免疫化を実施し、適切な親和性および特異性を示す材料をスクリーニングおよびプールすることによって、この問題に対処することが可能です。このような場合、最終的な抗体の性能を、過去のバッチと比較することで、均一性を保証しています。
なお、モノクローナル抗体とポリクローナル抗体、いずれを選択した場合でも、個々の解析について、抗体の希釈率を最適化する必要があります。抗体を過剰に用いた場合、標的タンパク質の免疫沈降には成功するかもしれませんが、非特異的結合が高くなったり、特異的なシグナルが低下したりする可能性があります。対照的に、抗体が少なすぎる場合には標的の回収率が低くなることが多いようです。
ChIPのコントロール抗体
クロマチンは、核酸に結合したタンパク質の混合物です。結果の有効性を保証するため、ChIP実験では、抗体、免疫沈降ビーズ、ChIPによって得られた解析対象のDNAに対し、クロマチンの非特異的結合に関するコントロールを含める必要があります。また、ChIP抗体の特異性を管理するため、ChIP実験に陰性コントロール抗体と陽性コントロール抗体を含める必要があります。
陰性コントロール抗体には、ChIP抗体と同一の種およびフォーマット(例:精製済み血清や、未処理の血清、腹水)の陰性コントロールIgGを用いましょう。例えば、正常な精製済みのマウスモノクローナルChIP抗体を用いる場合には、正常な精製済みのマウスIgGを陰性コントロールとして使用します。
精製済みのウサギポリクローナルChIP抗体を用いる場合には、正常な精製済みのウサギIgGを陰性コントロール抗体として使用します。また、適切な陰性コントロールIgGが利用可能でない場合には、「抗体なし」またはビーズのみのアプローチを選択してもよいでしょう。対応するIgGの方が優れた陰性コントロールとなることが多いですが、濃縮倍率の計算では陰性コントロールIgGまたはビーズのみのコントロールのいずれかを用いることができます。
陽性コントロール抗体には、RNAポリメラーゼIIやヒストンサブユニット(通常H3またはH4のN末端)など、豊富に存在する標的タンパク質を認識するChIP抗体と同一種由来の抗体を用います。陽性コントロール抗体は、ChIP抗体の選択の影響を受けない実験の別の側面を検証する助けとなり、実験のトラブルシューティングにも有用な場合があります。
特異性試験
抗体を選択する前に、対象の抗体の特異性を理解することが重要です。これは特に、修飾ヒストンなどの翻訳後に修飾されるタンパク質を標的とする抗体を用いて作業する場合に意識しておくと良いでしょう。この際、注意しておきたいのは、使用する抗体が、特定の修飾部位を含有するエピトープしか検出しないことの確認です。
抗体の特異性を評価するには、ドットブロット、ペプチドマイクロアレイ、ペプチド阻害アッセイなどの複数のアプローチがあります。特に修飾されたヒストンペプチドに対しては、類似したエピトープ(同一のヒストンサブユニットのジメチル化物とトリメチル化物など)との交差反応性を適切に評価するため、多数の検証方法を実施する研究室もあります。
ヒストン抗体の特異性を試験する信頼性の高い方法としては、AbSurance™ Histone Antibody Specificity Array(16-665、16-667、16-668)がおすすめです。これらのアレイでは、ヒストンH2、H3、H4の合計89種類の高品質なペプチドを、PVDFメンブレン上のスポットとして提供しています。アッセイは、単純なウェスタンブロットの様な手順からなっており、標準的な化学発光検出システムを利用します。また、マイクロアレイをベースとしたアプローチとは異なり、検出に追加のソフトウェアや高価な装置は必要ありません。
検証試験
抗体をChIPで検証するのが理想的です。しかし、ChIPのデータがない場合でも、必ずしもその抗体がChIPでは機能しないというわけではありません。ChIP試験のために抗体を選択する際は、その抗体について利用可能なすべてのアプリケーションデータを考慮しましょう。免疫細胞化学(ICC)、ウェスタンブロット(WB)、および/または免疫沈降法(IP)で機能するものがよいでしょう。
通常は、データがあるアプリケーションが幅広いほど、抗体がChIPで良好に機能する可能性が高くなります。例えば、免疫沈降法(IP)、免疫蛍光法(IF)、または免疫組織化学法(IHC)において検証済みの抗体の方が、ウェスタンブロットでしか検証されていない抗体よりも、ChIPで正の結果を供する可能性が高くなります。
しかし、これらのアプリケーションにおいて検証されていても、その抗体がChIPで良好に機能するとは保証できません。なぜなら、ChIP抗体は、ChIPでよく用いられる架橋法の影響を受けない、到達可能なエピトープを認識しなければならないからです。それでも候補抗体に優先順位を付け、あまり望ましくない抗体を除外する助けにはなります。
ビーズの選択
抗体をどのビーズに結合して用いるかも検討しなければなりません。ChIP抗体は、アガロースや磁気ビーズに直接結合するか、プロテインAまたはプロテインGビーズ、あるいはプロテインA/Gビーズブレンドに固定します。本来のChIPのプロトコールでは、アガロースビーズが用いられていますが、長期間ChIPを実施している研究者の多くは磁気ビーズに移行しています。磁気ビーズでは、磁気分離デバイスを用い、未精製のクロマチン混合物からタンパク質/DNA複合体を迅速に単離することができます。
アガロースビーズは、多くの研究者によって良好に用いられており、安価ですが、時間のかかる選択肢です。これらのビーズは、分離に遠心分離が必要で、非特異的結合を示す場合があるため、ブロッキングや細胞溶解液の事前精製などが必要となる場合もあります。
磁気ビーズとアガロースビーズの利点と欠点は次の通りです。
| 磁気ビーズの利点 | ・非特異的結合が少ない ・ブロッキングや事前精製が不要 ・洗浄中の取扱いが簡単 ・チューブ内のビーズが見える ・再現性の高い結果 |
|---|---|
| 磁気ビーズの欠点 | ・若干コストが高い ・磁気ラックが必要 ・非多孔(結合能はビーズの表面積に依存する) |
| アガロースビーズの利点 | ・結合能が高く(多孔性)、そのため非特異的結合も多い可能性がある ・必要とする装置が少ない(遠心分離またはろ過) ・コストがやや低い |
| アガロースビーズの欠点 | ・ブロッキングが必要 ・事前精製が必要 ・チューブ内で見えない ・取扱い中にビーズが失われる確率が高い |
ビーズの種類の選択は、実験に使用する予定の抗体の種類に依存して決まることが多いです。プロテインAビーズは、ウサギポリクローナル抗体に高い親和性を示します。プロテインGビーズは、すべてではありませんが、ほとんどのクラスのマウスモノクローナルIgGを含む多様な抗体に結合します。プロテインA/Gブレンドは、プロテインAとプロテインGの両方の結合特性が合わさっていることから、使用可能な抗体の種類という点では最も柔軟な選択肢です。メルクの研究・開発チームによると、プロテインA/Gブレンドを用いると、プロテインAまたはGを単独で用いた場合よりも、バックグラウンドが少なく、免疫沈降法の効率を損なうことなく、広範な抗体に使用可能であることが認められています。
どのビーズを選択するかに関わらず、磁気またはアガロースビーズをChIP反応に適用する順番が、ChIPシグナルに影響する可能性があります。
例の1つが、ビーズを捕捉抗体でインキュベーションし(室温で数時間、または4℃でオーバーナイト)、クロマチンを加えてからさらにインキュベーション(4℃で回転しながら1時間からオーバーナイト)する方法です。インキュベーション時間を延長すると、バックグラウンドシグナルとChIPシグナルの両方が増加する可能性がありますが、一般的に、標的に対する親和性が低い抗体は、長時間(オーバーナイト)のインキュベーションを行わないと、著しいChIPシグナルを示すことはありません。
他には、抗体をクロマチンとインキュベーションし、その後ビーズを添加する方法や、3つすべてを同時に添加する方法などが用いられています。3つすべてを同時に添加する方法も、問題なく機能する場合が多く、全体的な反応の実施に必要な時間が短縮されます。
ChIPテクノロジーにおける進歩
エピジェネティック修飾は、表現型の決定においてDNA配列と同様に重要であり、その研究においては、従来の遺伝学的アプローチに対し、タンパク質‐DNAの相互作用に焦点が当てられています。これらのエピジェネティックパターンや制御ネットワークの機能解析は、標準的なクロマチン免疫沈降法(ChIP)をベースとする技術を越えて進歩しており、ChIP-on-chip、ChIPにより単離されたDNAのゲノムワイドマイクロアレイ分析、ChIP-seq(ChIPの後に、免疫沈降したDNAのシークエンシングを行うもの)などがあります。
このようなハイコンテントアプローチは、転写因子やヒストンサブユニットといった調節・構造タンパク質が、ゲノムとどのように相互作用をするかを明らかにします。これらのタンパク質‐DNA複合体を、翻訳後修飾に選択的な高品質の抗体によって免疫沈降し、シークエンシングやマイクロアレイと組み合わせることで、配列特異的なDNA結合部位を高解像度で同定することができます。
以上、クロマチン免疫沈降法について解説しました。ヒストン修飾やDNAメチル化など、エピジェネティックな遺伝子の制御機序は、農業からヒトの健康に至るまで幅広い分野の研究に影響を及ぼし、その重要性に注目が集まっています。その解析手法の一つであるクロマチン免疫沈降法についても、覚えておけばきっと役に立つはずです。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




