不可逆的阻害剤と温度・pH変化による阻害

酵素活性を阻害する要因
酵素は触媒的な性質があり、反応への関与によって酵素自体が変化することなく、反応速度を加速します。酵素活性は多くの要因に依存しています。酵素活性に影響を及ぼすもっとも重要なものは、酵素濃度、酵素に特異的な基質の量、反応液のpH、温度、活性化因子や阻害剤の有無です。
酵素阻害剤は通常、酵素と結合して酵素-阻害剤複合体を形成する低分子化合物で、酵素の触媒活性を低下または完全に阻害し、反応速度を低下させます。酵素活性部位への阻害剤の結合は、その部位への基質の進入を防ぐことができます。あるいは、いくつかの阻害剤は活性部位以外の部位に結合し、酵素の立体構造変化を促して活性部位への基質の進入を防ぎます。酵素との相互作用のタイプに基づいて、阻害剤の結合は可逆的または不可逆的のいずれかに分類することができます(図1)。
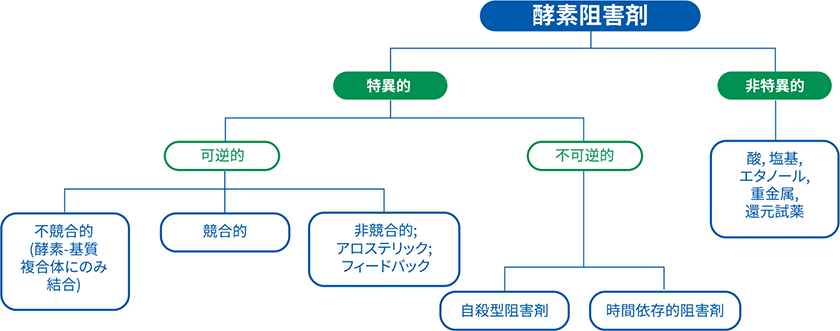
図1 一般的な酵素阻害剤の分類
本記事ではこの中でも不可逆的阻害剤について詳しく紹介します。また、阻害剤以外で酵素活性を低下させる要因として温度変化による阻害と、pH変化による阻害についても解説します。
不可逆的阻害剤の分類
不可逆的阻害剤は、その性質により非競合的です。不可逆的阻害剤には、酸やアルカリのように非特異的に作用するタンパク質変性剤や、ホロ酵素系の特異的な成分を攻撃するような特異的な作用剤が含まれます。
特異的な阻害剤は、次のように分類することができます。
- 補酵素阻害剤
- 特異的なイオン補因子の阻害剤
- 補欠分子族の阻害剤
- アポ酵素阻害剤
- 酵素の触媒部位を変性させるpHや温度などによる反応の生理学的修飾因子
ほとんどの不可逆的阻害剤は酵素の官能基と相互作用し、酵素活性を破壊します。これらの相互作用は、基本的に共有結合性です。これらの阻害剤は、酵素反応のメカニズムを研究する際に非常に有用です。
自殺型阻害剤
不可逆的阻害剤の特別なグループとして、自殺型阻害剤が知られています。これらは、酵素の活性部位に結合するまであまり反応性を示しません。自殺型阻害剤は、反応初期の数段階は正常な基質のように機能しますが、ポケットに入ると活性型の阻害効果を示し、標的に共有結合して酵素を殺し自分も不活化(自殺)します。
自殺型阻害剤は、正常な酵素反応メカニズムを用いて酵素を失活させるため、メカニズムベースの阻害剤または遷移状態アナログとしても知られています。酵素の遷移状態安定化作用を利用する自殺型阻害剤は、基質ベースの阻害剤よりも酵素への結合親和性が高くなります。
このアプローチは、副作用が少ない医薬品の開発に非常に有用です。しかし、遷移状態の構造は不安定で、特性もほとんど明らかにされていないため、遷移状態を正確に模倣する薬剤の設計は非常に困難です。プロドラッグは初期反応を受け、全体として静電性で3次元の中間遷移状態複合体を形成しますが、これは通常の基質と酵素の間で形成される遷移状態と非常に類似しています。これらのプロドラッグは、改変を重ねていくことで遷移状態分子の開発を進めるための指針となるでしょう。
一般的な自殺型阻害剤の例は、キサンチンオキシダーゼ活性を阻害する抗痛風薬であるアロプリノールです。この酵素は、まずアロプリノールをオキシプリノール(遷移状態アナログ)に活性化させ、オキシプリノールがキサンチンオキシダーゼの活性部位において、モリブデン-硫化物(Mo-S)複合体に非常に強力に結合することによって自殺を図ります。
アシクロビル(アシクログアノシン(2-アミノ-9-((2-ヒドロキシエトキシ)メチル)-1H-プリン-6(9H)-オン)は、もっとも一般的に用いられている非常に毒性が低い抗ウイルス剤の1つです。アシクロビルは、ウイルスのチミジンキナーゼによって選択的にアシクログアノシン一リン酸(アシクロGMP)に変換されます。アシクロGMPは細胞性キナーゼによってさらにリン酸化され、活性型の三リン酸型であるアシクロGTPになります。アシクロGTPは、ウイルスのDNAポリメラーゼに対する非常に強力な阻害剤で、ウイルスポリメラーゼに対して細胞性ポリメラーゼより100倍以上も高い親和性を示します。アシクロGTPはウイルスのDNAに組み込まれウイルスDNA鎖の伸長反応を停止します。
自殺型阻害剤は酵素を除去し、ES複合体(酵素-基質複合体)の形成を減少させます。Vmax値は低下し、さらに基質を加えても阻害を克服することはできません。この点において、自殺型阻害は非競合的阻害と似ています。
酵素阻害剤としての重金属イオン
水銀や鉛などの重金属は酵素に強力に結合し、活性を阻害することができます。重金属は、スルフヒドリル(-SH)基を有する酵素に高い親和性を示します。重金属が多量に存在すると作用が非特異的になりやすく、複数の酵素が阻害されるため、特にどの酵素が影響を受けるのか明確ではない場合もあります。重金属による重要な酵素の阻害は、中毒を引き起こす場合がありますが、これは金属イオンキレート剤の投与によって治療することができます。
時間依存的阻害剤
時間依存的阻害剤は、酵素に緩慢に結合する阻害剤で、阻害が認められるタイミングも遅くなります。これらの阻害剤は、非線形の初速度及び非線形の酵素活性の回復を示し、koff値(酵素と阻害剤の解離速度定数)も遅い傾向があります。時間依存的な阻害は重度の阻害で、これを克服するためには酵素のde novo合成が必要になります。
一部の時間依存的阻害剤は、共有結合的に酵素と相互作用します。これらの阻害剤ではkoff値が0に近づき、阻害は不可逆的です。これらの分子は、共有結合の種類によって反応機構についての情報が得られない限り、大抵の生物学的研究にはあまり有用ではありません。
興味深いことに、成功している多くの治療薬は時間依存的阻害剤です。このようにkoff値が遅い場合、酵素-阻害剤複合体からの阻害剤の遊離速度は基質濃度に依存していないため、創薬プロセスにとって魅力的です。
時間依存的阻害において興味深い治療標的の1つは、現在知られている薬剤の約60%の代謝に関与するチトクロームP450(CYP)3Aです。併用薬によるCYPの阻害は過剰曝露を引き起こす場合があり、いくつもの薬剤が市場から撤退しています。時間依存的な阻害は、薬剤の分解を阻害することによって薬剤の効力を高めることができます。これは、強力な結合、準不可逆的阻害代謝産物の形成、または共有結合付加体の形成によるCYP酵素の不活性化のいずれかによるものです。CYP阻害剤には、アジスロマイシンのような一般的な抗生物質や、抗うつ剤であるフルオキセチンが含まれます。
温度変化による阻害
ほとんどの酵素は、幅広い温度範囲にわたって安定していますが、生理的範囲内で最も良好に作用します。温度を下げることによって酵素活性を著しく低下させたり、反応温度を上げることによって活性を高めたりすることもできますが、これには上限があります。酵素はタンパク質であるため、高温では部分的に折り畳みがほどけたり、変性したりしてしまいます。したがって、反応液を高温の変性温度にすることで、反応を停止させることもできます(図2)。
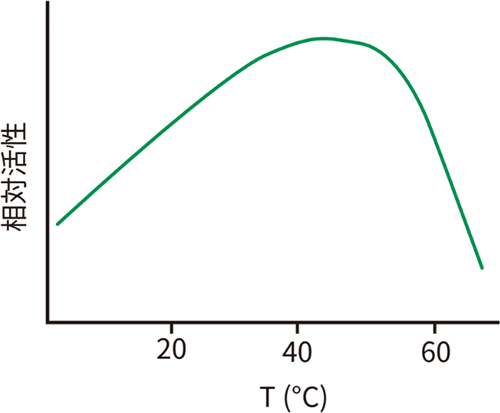
図2 温度による酵素反応への影響
反応温度が上昇するとQ10の原則に基づき、反応速度も速くなります。Q10すなわち温度係数は、温度を10℃上昇させた際に生物学的または化学的システムに生じる変化の速度についての尺度です。生物学的システムでは大体の場合、温度が10℃上がるごとに、反応速度が2倍になります。ただし、温度が上がりすぎるとタンパク質が変性してしまい、酵素活性が失われ、生物は死に至ります。Q110は次の式によって算出することができます。R1及びR2は、それぞれ温度T1及びT2における反応速度です。
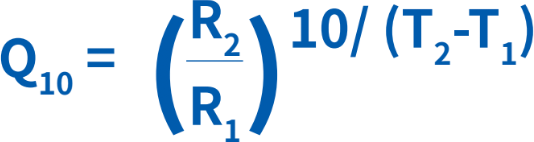
同様に、温度の低下によって酵素の形状が変化するため、温度を下げることによって酵素活性を減少させることもできます。ただしほとんどの場合、温度を生理的範囲まで上げると酵素活性も回復します。しかしながら、酵素は凍結融解の繰り返しに敏感である点に注意が必要です。凍結すると、氷の形成、水の結晶化による溶質濃度の変化、緩衝液の溶質の共晶およびその結果として生じるpH変化など、複数のストレスが生じる可能性があります。そのため、凍結した酵素を融解するのは1回限りとし、再度凍結する前に使い捨てバイアルに分注するようにしましょう。
pH変化による阻害
pHは、酵素が触媒する反応の速度に明らかな影響を及ぼします。各酵素には最適なpHがあり、それ以上または以下では、活性が低下したり完全に消失したりします。
酵素は次の理由により、狭いpH範囲以外では活性を示しません。
- 基質結合のpH感受性
- 酵素の触媒効率の低下
- 基質のイオン化
- タンパク質の構造変化(通常は極端なpHにおいて生じる)
アミノ酸側鎖は、酵素の活性部位において重要な機能を果たす弱い酸および塩基として作用します。このため、イオン化状態の変化によって、酵素活性に有害な影響が及ぶことがあります。酵素活性が変化するpH範囲に基づき、活性部位の構造にどのアミノ酸が関与しているのかについての重要な情報を得ることができます。例えば、pH 7.0付近における酵素活性の変化は、活性部位にヒスチジン残基が存在することを示しています。
酵素はpH変化に敏感なため、ほとんどの生体システムには、細胞内pHを維持するために高度に進化した緩衝システムが備わっています。ほとんどの哺乳類細胞では、細胞内区画や特定の組織内のpHが約7.2に維持されていますが、pHが大きく異なる区画もあります。例えば胃のpHは、ペプシンの活性に最適な1~2であり、ペプシンの活性は、pH 4以上になると急速に失われます(図3)。対照的に、腸内のpHは弱アルカリ性で、これはキモトリプシンの活性に最適です。膵臓から放出される炭酸水素がこのアルカリ度に寄与しており、胃から十二指腸に入る酸性化された食物を中和しています。細胞内では、酸性加水分解酵素に至適な状態になるよう、リソソーム区画のpHが酸性に保たれています。酸性加水分解酵素は、細胞質ゾル区画に放出されると活性が失われます。
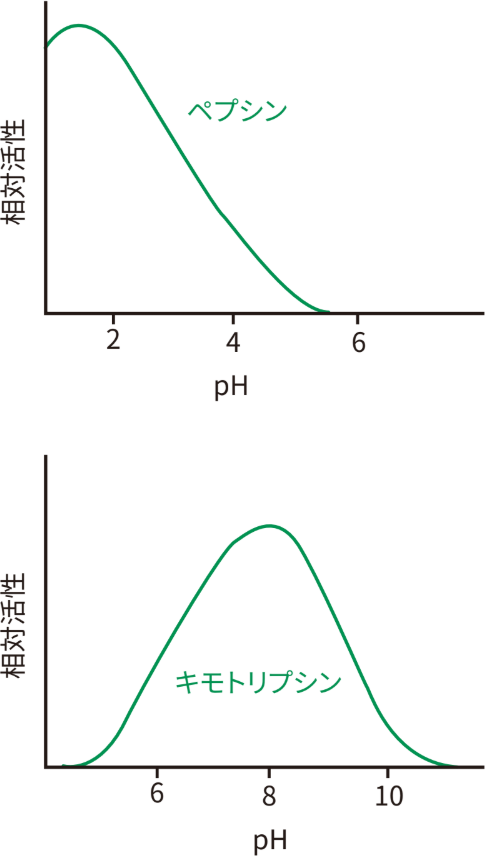
図3 異なる臓器における様々な酵素活性に対するpHの影響
以上、不可逆的阻害剤の種類と阻害剤以外で酵素活性を低下させる要因について解説しました。それぞれの仕組みや特徴をよく確認しておきましょう。
<無料PDFダウンロード> 阻害剤 選択ガイド
この阻害剤選択ガイドでは、酵素に対する阻害剤や受容体への阻害剤の作用機序について解説し、適切な阻害剤選びに役立つ情報をご紹介しています。
▼こんな方にオススメ
・最適なプロテインキナーゼ阻害剤を選びたい方
・各種シグナル阻害剤の背景知識を学びたい方
・これから阻害剤を使った実験を行う可能性がある方

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須