研究や医療で活用される酵素阻害剤とは

酵素阻害剤の重要性
酵素阻害剤は、生物学的プロセスの研究に用いられるほか、疾患を緩和する治療薬や、殺虫剤、農薬など様々な用途で活用されています。
この記事の前半では、酵素阻害剤が医療、研究においてどのように用いられているか紹介し、その重要性や利点について解説します。また、後半では酵素阻害剤について理解するために必要な知識として、酵素の活性部位と特異性について言及します。
酵素阻害剤は代謝活性を制御することができ、生化学反応を阻害したり、その速度を遅らせたりします。そして生体システムにおいては主要な制御機構の役割を果たしています。治療的に重要な薬剤の多くは、特定の酵素を阻害することによって作用しています。
酵素は生命活動において絶対不可欠なものですが、異常に高い酵素活性は、疾患の原因となることがあります。そのため、疾患の緩和を目的とする阻害分子の開発において、過剰な活性を持つ酵素は非常に興味深い標的です。酵素阻害剤を用いた酵素触媒の制御は、感染症の予防、細胞周期や細胞増殖への介入、高血圧の治療、炎症反応の制御などにおいて重要です。
阻害剤は治療薬として作用するだけでなく、生物学的基礎研究及び臨床研究でも重要な役割を果たしています。可逆性阻害剤は、酵素の精製に用いることができますし、共有結合性阻害剤は、活性部位のアミノ酸の特定によく用いられます。また、固定化し、蛍光色素で標識した阻害剤は、酵素の細胞内部位の局在化や特定に用いることができます。
また、多くの阻害剤は強力な毒物でもあり、農薬や除草剤に使用されているものもあります。
研究に活用される低分子阻害剤
有機化学的な手法によって生命現象を解明しようとするケミカルバイオロジーのアプローチは、様々な生物学的プロセスを研究するため、機能獲得型および機能喪失型アプローチの両方においてよく活用されています。
化学遺伝学を例にあげると、特定のシグナル伝達経路に関与する特定のタンパク質/酵素の活性化や阻害に、低分子有機化合物やペプチドが用いられています。これによって、特定の細胞タンパク質が誘導または抑制されている場合の表現型を解析することができます。ある種の低分子生理活性物質は、生物学的表現型を制御する個々のタンパク質やプロセスを、時間的および空間的に調節する強力なアプローチとなります。
これらの低分子化合物は、幹細胞の運命に影響を及ぼす生物学的経路について理解を深める助けにもなっています。これらの低分子化合物は多能性幹細胞の自己複製、生存、ダイレクトリプログラミング、分化の制御に用いられています。さらに、細胞増殖、分化、代謝などを制御する広範な細胞内コミュニケーションネットワークを規定・維持しているシグナル伝達分子の同定にも役立っています。
プラスミドDNAや遺伝子ノックダウン、遺伝子の過剰発現といったその他のアプローチと比較すると、化学遺伝学は、培養細胞で技術的にも簡単に実施することができ、資源や時間もあまり必要としません。
RNAiアプローチと比較すると、低分子化合物は標的タンパク質に迅速かつ直接作用するという利点があり、多くの場合は洗浄するだけですぐに作用を逆転させることができます(図1)。ほとんどの低分子化合物は迅速に作用するため、ライブイメージングにも理想的です。また、阻害剤の使用によって、用量反応に関する情報も得られます。
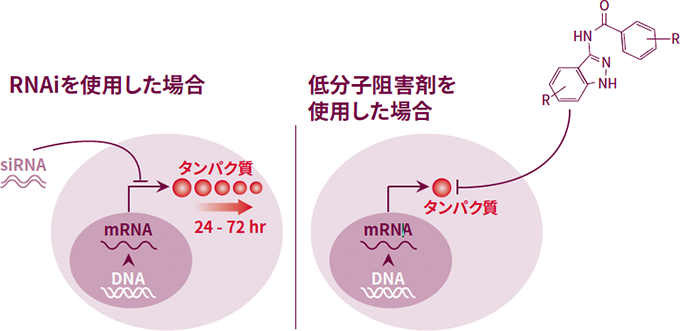
図1RNAiと低分子阻害剤の作用部位の比較
<RNAiと比較した低分子阻害剤の利点>
RNAi
- 初代細胞など核酸の導入が困難な細胞では使いにくい
- 半減期が長いタンパク質をコードするmRNAへの使用は推奨されない
- 二次構造が強力で、ノックダウンが困難なmRNAへの使用は難しい
- ゆるやかなタンパク質の減少により、効果が緩慢かつ可逆的である。
- 用量反応曲線の測定が困難
低分子阻害剤
- 細胞透過性であることが多い
- 遺伝子導入剤が不要
- 低分子は、特定のタンパク質を阻害又は不活性化することによって作用する
- 阻害剤に基づいた作用が迅速で、阻害剤から構成される薬剤(治療薬)はしばしば可逆的である
- 用量反応曲線から様々な情報を得られる
- 用量を容易に操作できる
酵素の活性部位と基質特異性
酵素は、それらが触媒する反応について特異的です。それぞれの酵素は通常、単一の基質または一対の基質(生体分子反応の場合)に対して作用します。一部の酵素は近縁種の基質分子に作用することがありますが、ほとんどの場合、効率はそれぞれ異なっています。
酵素には、反応が起こる活性部位として知られる小さな領域があり、この領域は典型的には約20前後のアミノ酸残基から構成されています。酵素は、基質を活性部位に結合することによって、生物学的反応を触媒します。この結合により、基質の化学結合における電子の分布が変化し、反応の活性化エネルギーが低下するため、最終産物の生成が可能となります。反応を終えるとこの最終産物は活性部位から放出され、酵素は再生し、別の反応を触媒することができます。基質は、イオン性相互作用、水素結合、疎水性の非極性相互作用、金属イオン活性化因子との配位結合により、活性部位と相互作用します。
活性部位の構造は、基質分子の構造と相補的であるため、1つの活性部位に対して特定の基質しか結合することはできません。ごくまれに、似た構造の分子も基質として作用することができますが、反応速度は至適速度よりも低くなります。このことは、鍵と鍵穴モデルとしてよく知られています。
しかし、鍵と鍵穴モデルですべての反応を説明できるわけではありません。このため、誘導適合説が提案されました。この説は、基質も酵素の最終形状を決定する役割を果たすという点を考慮しており、酵素の形状は柔軟であることを意味しています(図2)。酵素-基質結合の誘導適合モデルでは、未結合の酵素の活性部位の形状は、基質の形状に完全に相補的ではありません。
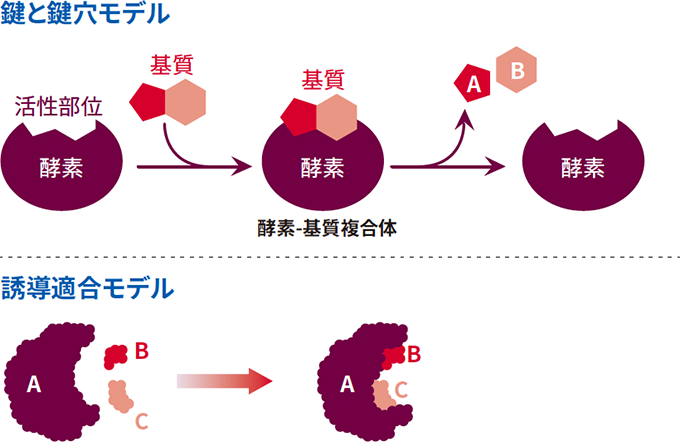
図2 基質結合の鍵と鍵穴モデルおよび融合適合モデル
誘導適合説に基づくと、ある化合物単体が酵素に結合できても、酵素構造が歪んでいたり、分子が小さ過ぎて正しい配置を促すことができなかったりする場合には、迅速な反応が起こらない現象を説明することができます。一方で、酵素が実際に基質と結合すると、活性部位において立体構造変化を起こし、基質の形状に相補的な新しい形状になります。ほとんどすべての酵素はタンパク質なので、活性部位の近傍にあるアミノ酸側鎖の性質も非常に重要になります。
酵素は、複数の基質に対して異なる特異性を示す場合があります。酵素の中には、1つの基質に対してのみ絶対的な特異性を示すものがありますが、その他の酵素は、類似の官能基、側鎖、又は鎖上の位置を有する基質と反応する場合があります。もっとも特異性の低い酵素は、その他の構造的特徴に関わらず、特定の化学結合において反応を触媒します。
以上、酵素阻害剤の重要性と、酵素の活性部位について解説しました。酵素阻害剤は医薬品や研究ツールとして重要視されている化合物です。酵素やその仕組みについてよく理解し、適切に活用できるようにしましょう。
<無料PDFダウンロード> 阻害剤 選択ガイド
この阻害剤選択ガイドでは、酵素に対する阻害剤や受容体への阻害剤の作用機序について解説し、適切な阻害剤選びに役立つ情報をご紹介しています。
▼こんな方にオススメ
・最適なプロテインキナーゼ阻害剤を選びたい方
・各種シグナル阻害剤の背景知識を学びたい方
・これから阻害剤を使った実験を行う可能性がある方

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




