プロセス化学とは何か?~プロセスケミストに必要な「心構え」~

我々が服用する薬の多くは、有機合成化学の技術で製造されています。このため、多くの合成化学者が製薬企業で働いています。
製薬企業における合成化学は、大きく2つに分けられます。一つが創薬化学(メディシナルケミストリー)、もう一つがプロセス化学(プロセスケミストリー)です。
前者については薬学部の講義でも習いますし、多くの教科書や成書も出版されているので、比較的広く知られているでしょう。
しかし後者のプロセス化学については、その内容について知る機会はあまりないのではと思われます。本稿では、そのプロセス化学について紹介し、プロセス化学者になるために必要な心構えなどについて述べてゆきましょう。
いわゆる創薬化学者の仕事は、化合物の構造を様々に変換し、試行錯誤をしながら医薬候補化合物を創出することです。
これに対してプロセス化学者の使命は、こうして創り出された医薬品(または医薬品候補化合物)を、多くの患者さんが服用できる量だけ製造するための、道筋を決めることにあります。
いわば、創薬化学者のバトンを受けて、新たな医薬を社会に届けるための役割です*1。
プロセス化学とは?
創薬研究の初期段階では、化合物は数ミリグラム程度合成すれば事足ります。毒性試験などの段階では化合物がかなり多量に必要になりますが、それでもせいぜい数十~数百グラム程度です。
しかしプロセス化学で扱う化合物の量は、数百キログラムからトン単位に及びます。
ここまでの量になると、あらゆる面で小規模な合成とは異なる配慮が必要です。しかもこれら化合物は、経済的に見合うコストで、安全かつ大量に供給されねばなりません。
そこで、大量合成に通暁したプロフェッショナルである、プロセス化学者が必要になるのです。
大量合成の難しさ
いわゆる化学工業やファインケミカルと呼ばれる分野でも大規模な合成を行いますが、これらの分野では一般に、低分子量で単純な構造の化合物を扱います。
しかし医薬分子はこれらに比べれば分子量も大きく、多くの官能基を含んだ、はるかに複雑な構造を持ちます。このためプロセス化学の難しさの質は、通常の化学工業のそれとは全く異なります。
大量合成は、単に大きな容器で大量の試薬を反応させればいいというものではありません。反応のスケールが大きくなると様々な問題が生じるため、実験室スケールと同じやり方ではうまく反応が進行しなくなるのです。
このため、創薬化学が合成した際のルートをそのままなぞるのではなく、検討を重ねて様々に改良していく必要があります。
反応に用いる容器としては、実験室スケールではもっぱらガラス製のフラスコが用いられますが、数百リットルといった大スケールでは強度が不足します。このため、アルカリ性環境で反応を行う場合にはステンレス製、酸性の場合にはグラスライニング(金属表面を耐食性ガラスでコーティングしたもの。いわゆるホーロー)製の反応釜が使われることが主流です。
この他、ハステロイ(高耐食性・耐熱性のニッケルクロム合金)や、チタン製の反応釜が用いられることもあります。
撹拌についても、大スケールになると同じようにはいきません。実験室規模の合成反応では、フラスコに磁気撹拌子を放り込み、マグネチックスターラーでかき混ぜてやるだけで、ほぼ問題なく反応が進行します。
しかし反応の規模が大きくなると、磁気撹拌子では十分な撹拌ができず、試薬が十分溶解しなかったり、反応に時間がかかったりという問題が起きます。
特に、溶媒に溶解しない固体の試薬が入っている場合、この問題は顕著です。このため、メカニカルスターラーと呼ばれる、棒に接合された羽根(撹拌翼)をモーターで回転させて撹拌するような方法が採られます。
その他、抽出・洗浄・溶媒留去、結晶の濾過・洗浄・乾燥といった実験操作も、小規模の場合とは全く異なる困難があります。
このため、これらに用いられる器具も実験室規模のものとは大きく異なっており、それぞれに工夫が加えられ、日夜進歩しています。
反応熱は最大の敵
大スケール反応で、最大の問題となるのが反応熱です。
反応を行う容器を球形と仮定した場合、その体積は半径の3乗に比例しますが、容器の表面積は半径の2乗に比例します。そして反応熱が逃げる速度は、容器の表面積に比例します。
すなわち、反応のスケールが上がると熱が逃げる速度が発熱速度に追いつかず、内部温度が上昇しやすくなるのです。
その熱によって反応が加速され、さらに熱が発生する……というサイクルが起こると、反応が暴走して噴出、あるいは爆発といった事態にさえつながります。
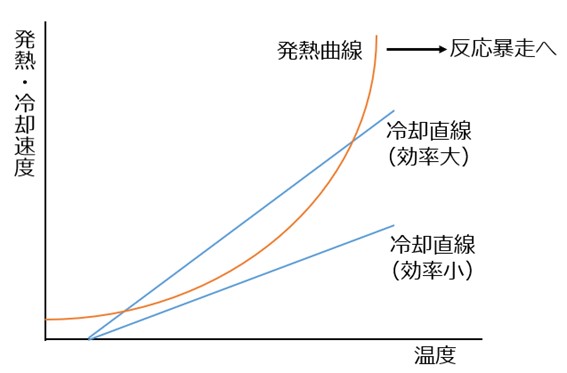
セメノフ図。冷却速度は、冷媒との接触面積や伝熱係数によって決まる。
この速度を発熱速度が上回ると反応の暴走につながる。
このため、小スケールでは特に問題なく行えた反応でも、そのまま大スケールに拡大したのでは、非常な危険が伴うことになります。発熱速度と冷却速度を予測した上で、内温を測定しながら少しずつ試薬を加えていくなど、化学工学の知識と慎重な実験操作が必要になります。
こうした要因があるため、一度に反応スケールを大きく上げるのは危険です。一度に可能なスケールアップ幅は、5~10倍程度が限界とされます。
少しずつスケールアップし、そのたびに出てくる問題点を洗い出し、段階的に修正してゆくことになります。
危険な試薬・溶媒を避ける
大量合成の際に事故が起きると、当然その規模も大きなものになります。このため、危険性をできる限り低下させる工夫が必要になります。
発火性のあるtert-ブチルリチウムや、爆発性のあるジアゾメタンのような危険な試薬は、大量合成では使用不可です。
そこまで危険なものでなくとも、毒性があるものはできる限り用いない努力が必要になります。たとえば、毒性の高いスズ化合物を用いるStilleカップリングを、安全性の高い鈴木-宮浦カップリングに置き換えるなどの工夫です。
溶媒も検討すべき対象です。たとえば発がん性の高いベンゼンは使用を避け、似た性質のトルエンなどが代わりに用いられます。低極性溶媒として一般的なヘキサンなども、引火性・変異原性などがあるため、ヘプタンなどで代用することが多くなっています。ジクロロメタン・クロロホルム・N, N-ジメチルホルムアミド(DMF)など環境負荷が高い溶媒も、可能な限り使用を避ける方向にあります。
プロセス化学において溶媒として推奨されるのは、メタノール・エタノール・アセトン・酢酸エチルなどです。水を反応溶媒として用いる工夫も進んでおり、うまく使えれば最もグリーンな溶媒ということになるでしょう。
コスト低減
医薬品企業としては、製品の信頼性が第一であることは言うまでもありませんが、製造コストを低減することも極めて重要になります。
1%でも収率を高められれば、それはそのまま会社の利益に直結します。
また、反応や精製の工程をできるだけ少なくする工夫も不可欠です。実験室では何気なく行っている抽出・精製・溶媒除去などの操作も、大スケールでは一つ一つに非常なコストと時間がかかり、リスクを伴います。
このため、ワンポットでいくつかの段階をまとめて行ったり、精製操作を省いて次の反応を行ったりという工夫が、死活的に重要になってきます。
保護基は、使わないことがもちろんベストですが、脱保護後に精製操作を必要としない保護基(アミノ基に対するtert-ブトキシカルボニル基(Boc基)など)を選択するだけでも、大きくコストが変わります。
実験室規模では、精製操作としてシリカゲルカラムが最もよく使われます。しかしプロセス化学の規模では、使用するシリカゲルと溶媒の量が膨大なものになるため、できる限り避けたい選択肢です。反応の終わった溶液から直接結晶化によって生成物を分離できれば、それがベストです。
溶媒抽出・濃縮を行い、再結晶で精製を行うもありますが、大スケールでの溶媒留去は非常に時間がかかって困難であるため、あくまで次善の手段です。
単純に、安価な試薬を選択して用いることも見逃せない工夫です。アミド合成によく用いられる、カルボジイミド系・ウロニウム系などのカップリング試薬は、高価なものがほとんどです。これを塩化チオニルなどを用いた酸塩化物法に置き換えられれば、大きなコストダウンとなります。
細かいところでいえば、同じカルボン酸のメチルエステルとエチルエステルで、かなり価格が異なるといったケースは珍しくありません。
後述するように、一度合成ルートを決めてしまうと簡単に変更できないという事情もありますので、後で安い試薬の存在に気づいても差し替え不可ということになりかねません。プロセスケミストであれば、普段から試薬カタログにしっかり目を通し、価格に注意を払っておくのも必要なことでしょう。
溶媒は大量に使用しますので、コストにもかなり大きく響いてきます。実験室規模では、DMFやジメチルスルホキシド(DMSO)はよく使われる溶媒ですが、これらはやや高価であり、高沸点のため除去しにくくもあります。
このため、これらはできる限りアセトンなど安価な溶媒に置き換える方向で検討がなされます。
合成ルートの検討
創薬研究段階で用いられていた合成ルートは、これまで述べてきたような問題点を考慮していません。
また、通常の試薬カタログに収載されている化合物でも、メーカーによっては数十キログラム規模での供給が困難な場合があります。
スケールアップ時に供給元を見直さなくて済むよう、バルク量供給対応な試薬メーカーからの購入を検討することも重要です。こうした点を含め、プロセス化学者がルートや原料供給元を検討し直す必要が出てきます。
一般に合成ルートは、一つの中間体に次々と反応を施していく直線的なルートよりも、いくつかのパーツに分けてそれぞれ変換を進め、終盤近くでそれらを結合させる収束的なルートの方が、効率・コスト両面で優れているといえます。
また、一部の中間体を外部の合成会社に製造委託するケースも多くあります。どこまでを外部委託するか、コスト・信頼性・納期などを考慮して決定しなければなりません。
各工程で行う反応も、徹底的に検証し、収率を極限まで高めつつ、信頼性の高いものにする必要があります。たとえば、試薬に含まれるわずかな水分が収率に大きく影響し、ふらつきの原因となることもあります。
こうした不安定要因を検証し、しっかりと除いていけば、収率は0.1%の桁まできっちりと再現するようになります。
特に注意すべきは不斉点を持った化合物で、合成の難易度が跳ね上がります。不斉点を導入する段階や手法によって、収量やコストは大きく変動します。プロセス化学者にとって、最も検討しがいのあるところといえます。
不斉な化合物を得るために、光学分割はよく用いられる手法です。技術的には比較的簡単ですが、化合物の半量が無駄になること、工程数が増えることなどがデメリットです。リパーゼによる不斉加水分解あるいは不斉アシル化は、大規模合成にも応用しやすく、広く使われる手法となっています。
不斉触媒を用いた各種反応は、ここ40年ほどで大きく進展した分野です。現在も多くの反応あるいは触媒が編み出されつつありますが、工業的規模での合成に適用可能な、信頼性の高いものは決して多くありません。
ただし近年の新規医薬候補化合物は、不斉点を多く持った合成難易度の高いものが増加する傾向にあります。「この反応の大スケール化は無理」とばかり言っておれない状況であり、新たな反応を積極的に取り入れる努力が望まれます。
不純物の問題
プロセス化学にとって大きな問題となるのが、不純物の存在です。どのような合成手法を用いても不純物の発生は避けられず、しかも完璧な除去は不可能です。
しかしこれら不純物は薬害などの原因となることもあるため、できる限り低減させねばなりません。
不純物は、大きく有機不純物・無機不純物・溶媒の3種に分けることができます。有機不純物は、製造工程で副生成物としてできてくる有機化合物です。
また、購入した試薬に含まれる不純物由来のものもあります。特に、医薬化合物本体と類似の構造を持っているものは除去が難しく、生理作用を持つ可能性もあります。このため、医薬品原末に0.1%以上含まれる不純物については、その構造を決定し、場合によっては生理作用の有無を確認する必要もあります。
無機不純物は、反応に用いた金属試薬などに由来する不純物です。特に、クロスカップリング反応に触媒として用いたパラジウムなどが残存するケースは多く、除去が難しいことも少なくありません。これらも、日本薬局方などに定められた基準値に従い、定量・評価を行う必要があります。
メーカーごとに試薬の製法は異なっており、不純物の組成にも差があります。スケールアップの際に違うメーカーの試薬を用いると、含まれる不純物も異なるものになり、管理が難しくなります。創薬研究の段階からプロセス化学の段階に至るまで、信頼のおけるメーカーの試薬を一貫して用いるのが理想です。
検討の事例
実際に、プロセス化学者が行った合成ルート検討の事例を見てみましょう(図1)。最初に取り上げるのは、アルドース還元酵素阻害剤FK366の合成です*2。
創薬研究の段階では、市販の試薬を出発物質として、8段階の反応を経て目的物2を合成していました(図1)。ただしこのルートは総収率が26%とやや低く、危険性のある水素化ナトリウムや、高価で除去が難しい溶媒DMFを用いるなど、改善の余地があるものでした。
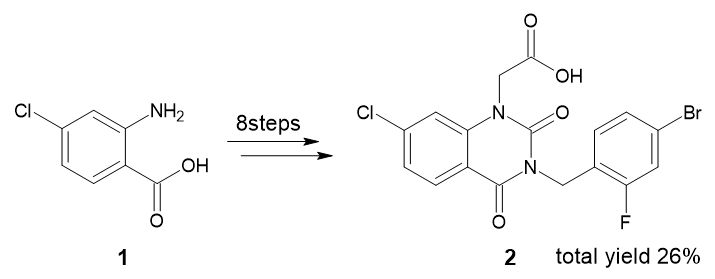
図1 FK366の当初の合成ルート
そこでプロセス化学部門でルート検討を行いました(図2)。
まずキノキサリンジオン骨格(3)を構築し、シリル化を経てブロモ酢酸エチルを作用させることで、1位選択的にアルキル化が可能なことがわかりました。ここに、アセトン中炭酸カリウム存在下で5を作用させて置換反応を行い、6を得ます。
単離された6を乾燥することなく次の加水分解反応を行い、最終目的物のFK366(2)の合成が完了しました。工程数を4段階に短縮した上、総収率を約85%にまで大きく向上させ、1ロットあたり640 kgという規模での製造を実現しています。
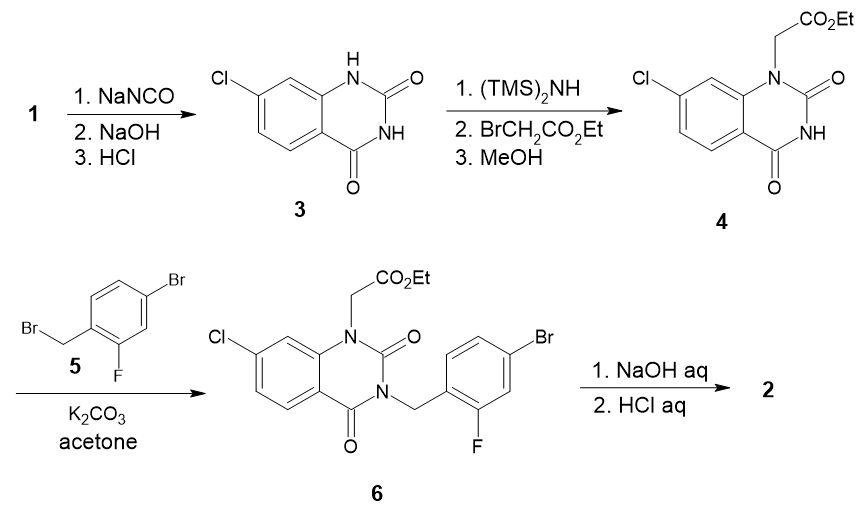
図2 FK366の改良合成ルート
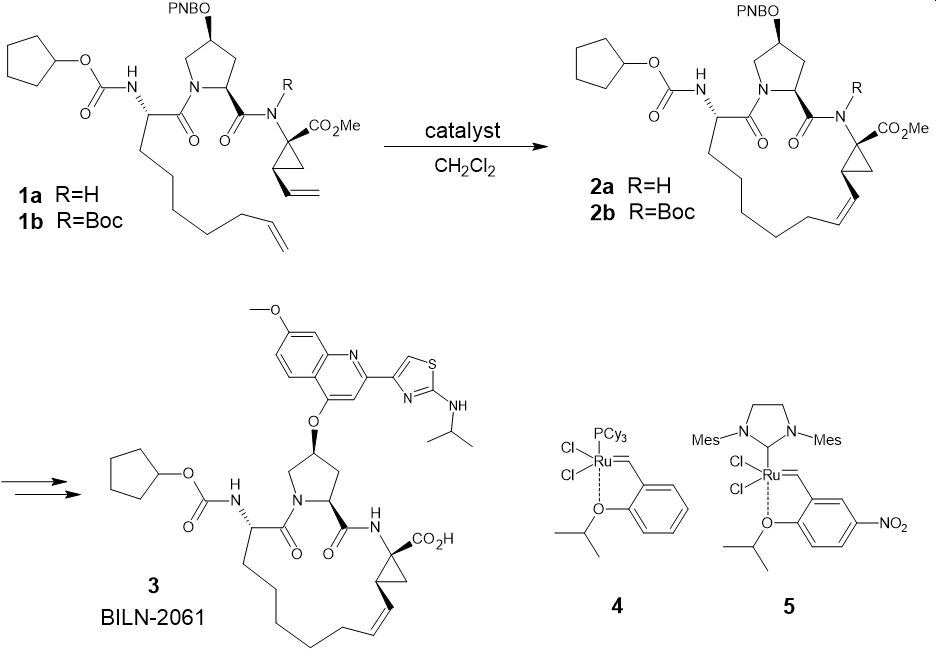
次に、C型肝炎ウイルスのNS3プロテアーゼを阻害する化合物BILN-2061の合成を見てみましょう(図3)。
この合成では、大環状骨格をオレフィンメタセシス反応で構築しています*3。当初のルートでは、前駆体1a (R=H)に対して触媒4 (5mol%)を作用させて環化体を得ていました。
しかしこの場合、残存する触媒を除くためにキレート剤溶液による洗浄、シリカパッドによる濾過に加え、活性炭処理を複数回行う必要がありました。
しかしこの後、アミド窒素をBoc基で保護した前駆体(1b)を用いることと、触媒を5に変更することで、90%前後の環化収率を維持しつつ、触媒量を0.1 mol%まで低減できることが判明しました。
この改良により、シリカパッドや活性炭による処理工程を省きながら、触媒の残存量を5 ppm以下に抑えることに成功しています。
GMP
医薬品は、病気にかかった人の体内に入っていくものです。
その製造には、当然ながら極めて厳しい安全基準が課されています。この基準は国際的な取り決めのもと運用されており、日本では「医薬品の製造管理及び品質管理の基準」と呼ばれます。一般には、Good Manufacturing Practiceを略し、GMPと称されています。
GMPでは、原材料の入荷から製品の出荷に至るまで、細かな安全性保証のための規定がなされています。製造者は、製造管理基準書、衛生管理基準書、品質管理基準書、製品標準書など多くの書類を作成し、提出せねばなりません。
途中で製造法を変更したり、新しい施設での製造を開始するような場合は、各国の管理機関へ申請書などを改めて提出し、承認を得る必要があります。前述した、「簡単に合成ルートは変更できない」というのはこのあたりのことです。
プロセス化学者になるには
以上述べてきたように、プロセス化学者には有機合成化学についての深い知識と経験が不可欠です。
生理学や分子生物学についての知識は、創薬化学者ほどには必要とはしませんが、化学工学や結晶学などについて学んでおく必要はあります。また、製造設備についての知識や、安全工学などを身につけておくことも重要です。
プロセス化学者に必要な資質は、やはり観察眼と洞察力ということになるでしょう。反応をよく観察し、何が起きているかを把握して正しい対策を立てられることが、よいプロセス化学者になるための第一歩です。
ただし、そのためには相当な経験も必要ですので、創薬化学者としてある程度の経験を積んだ上で、プロセス化学部門に移籍するケースも多く見られます。
プロセス化学は一見地味ではありますが、多くの患者さんが必要とする高品質の医薬を、必要な量供給するための、社会に不可欠な仕事です。
やりがいのある仕事であり、特に有機合成が好きな人であるならば、いつか目指してみたい職種といえると思います。
大量合成(スケールアップ)に関するお問い合わせ
Sigma-Aldrich®ではお客様の様々な研究ステージでの合成をサポートするために、有機合成分野のビルディングブロックや触媒、材料科学分野のモノマー・ポリマーや金属・無機化合物など、カタログ掲載化合物 約25万品目をバルク供給しています。
バルク供給ご希望の化合物について、以下よりお問い合わせください。
<References>
*1 プロセス化学全般について
「プロセス化学 第2版: 医薬品合成から製造まで」 村瀨 徳晃 (監修, 翻訳) 丸善出版
「医薬品のプロセス化学」 日本プロセス化学会 編 化学同人
*2 S. Goto et al. Org. Process Res. Dev. 7, 500 (2003); 西脇正憲 有機合成化学協会誌 61, 464 (2003)
*3 P. Wheeler et. al., Org. Process Res. Dev. 20, 1182 (2016)

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須