MAF増幅による乳がん転移能の獲得 :エピジェネティックな協調がもたらすエストロゲン受容体の機能拡張

解明が待たれた転移の謎
ホルモン受容体陽性(ER陽性)乳がんは、増殖と転移の両方にエストロゲンを必要とする乳がんのタイプです。エストロゲン駆動の癌細胞増殖に対してはタモキシフェンなどの内分泌療法が臨床的に用いられますが、内在性または獲得性の治療抵抗性により長期的成功は限定的であり、再発や遠隔転移は患者の予後を大きく左右する深刻な課題であり続けています。
特に、転写因子MAFの遺伝子増幅が見られる症例では、骨転移のリスクが著しく高く、疾患無再発生存期間(DFS)と全生存期間(OS)の短縮と関連しています。しかし、このMAF増幅が、具体的にどのような分子メカニズムを通じて乳がんの転移能を獲得させるのか、特にエストロゲンシグナルとの相互作用においてどのように作用するのか、その核心部分は長らく不明でした。
なぜMAF増幅を持つがん細胞は、同じ癌遺伝子依存性を示す他のER陽性乳がんよりも高い転移性を示すのでしょうか。
ER陽性乳がんの運命を左右する女性ホルモン、エストロゲン。このエストロゲンシグナルと、予後不良マーカーであるMAF増幅が、どのように連携し、がん細胞に転移という最終段階の悪性度を付与するのか。この根源的かつ臨床的に重要な問いに対し、遺伝学、エピジェネティクス、そしてプロテオミクスを駆使して、その分子基盤の深淵に切り込んだのが、今回ご紹介する画期的な研究です。
MAFとERα、運命を書き換える関係性
本研究が突き止めた核心は、転写因子MAFが乳がんの生存と増殖の鍵を握るエストロゲン受容体α(ERα)と物理的に直接結合するという、驚くべき発見です。この予期せぬ分子間の関係により、ERαは本来の働きを大きく逸脱します。MAFは、ERαをゲノム上の全く新しい領域へと導き、そこでクロマチン構造を活動的な状態へと書き換える「エピジェネティック・リモデリング」を引き起こします。これにより、これまで眠っていた数々の転移促進遺伝子群の発現が、エストロゲン依存的に新たに許可(ライセンス)されるのです。
この発見の意義は、単一の遺伝子増幅が細胞内の主要なシグナル伝達経路を乗っ取り、その機能を悪性化のために再定義するという、がんの巧妙な生存戦略を白日の下に晒した点にあります。遺伝子のコピー数異常という「遺伝的要因」、ホルモンという「環境要因」、そしてクロマチン制御という「エピジェネティック要因」。これら三者が複雑に絡み合い、転移という致死的な現象を駆動する。このダイナミックな描像は、がんの悪性化メカニズムの理解に新たなパラダイムを提示し、治療戦略そのものに大きな変革を迫る可能性を秘めています。
エピジェネティックなリモデリングによる転移メカニズムの解明
この革新的な知見は、細胞生物学分野で権威の高い学術雑誌 Nature Cell Biology に掲載された論文、「MAF amplification licenses ERα through epigenetic remodelling to drive breast cancer metastasis(MAF増幅はエピジェネティックなリモデリングを介してERαを活性化し乳がん転移を駆動する)」で報告されました。この研究を主導したのは、スペインのバルセロナ生物医学研究所に所属するロジャー・R・ゴミス(Roger R. Gomis)博士らの国際研究チームです。彼らは最先端のオミクス解析技術を統合し、長年の謎であったMAFによる転移促進メカニズムの解明に成功しました。
本研究の背景には、生命の計図であるゲノムの読まれ方を制御する「エピジェネティクス」の概念があります。
DNAはヒストンタンパク質に巻き付き、クロマチンと呼ばれる構造体を形成しています。このクロマチンの凝集度が変化することで、遺伝子の発現、すなわちON/OFFが緻密にコントロールされているのです。通常、ERαはエストロゲンと結合することで特定の標的遺伝子を活性化させますが、研究チームは、MAFがこのプロセスに直接介入し、ヒストン修飾を介してクロマチン構造を巧みに操ることで、ERαの機能を転移に有利な方向へと逸脱させることを明らかにしました。
近接依存性標識による細胞内相互作用の新たな発見
研究チームは、MAFが細胞内でどのタンパク質と相互作用するのかを網羅的に解き明かすため、近接依存性標識という手法が用いられました。本研究では、近接依存性ビオチン化同定法(BioID)により、生きた細胞内で標的タンパク質(この場合はMAF)の近傍に存在するタンパク質をビオチンで標識しました。
このビオチン標識されたタンパク質をストレプトアビジンが共有結合しているビーズを用いて回収し、そのタンパク質を質量分析で同定することで、標的タンパク質の近傍に存在するタンパク質の特定に挑みました。この網羅的解析の結果、MAFの新たな相互作用パートナーとしてERαが同定されました。この結果は、これまで別々の経路と考えられてきた二つの因子が、実は物理的に結合し協調して機能するという、本研究の根幹をなす発見の端緒となりました。
エピジェネティクスによりクロマチン構造の変化を特定
本研究ではさらに、ChIP-seqやATAC-seq解析を駆使したエピジェネティックなアプローチにより、クロマチン構造の変化を調べました。驚くべきことに、ChIP-seq 解析の結果、MAFを過剰発現させた細胞では、ERがこれまで知られていなかったゲノム部位にも結合することが示されました。これらの部位は、FGF18、PTHLH、JAG1、TMEM2、TGFA、JAK1、SHHといった転移を促進する遺伝子に関連するエンハンサー領域に位置していました。また、ATAC-seq解析により、MAF陽性の乳がん細胞株においてエストロゲンの刺激がクロマチン状態の変化をもたらすことが測定されました。
MAFの過剰発現は、エストロゲン刺激に応答したERαのゲノム上の結合ランドスケープを劇的に変化させ、本来は不活性なエンハンサー領域を含む新たなゲノム領域へとERαを再配置(リダイレクト)させていたのです。さらに、このエピジェネティックな変化の鍵を握る分子として、ヒストン脱メチル化酵素KDM1Aが特定され、実際にKDM1A阻害剤(ORY-1001)を用いると、一連の転移促進遺伝子の発現が抑制され、マウスモデルにおける転移能も顕著に低下することが示されました。
がん転移研究における大きな可能性
がん転移研究における大きな可能性
結論として、本研究では最先端の解析技術を統合することで、MAFの増幅がどのようにERαの機能を変え、クロマチンのエピジェネティックなリモデリングを介して、乳がんの転移を促進するのかという、遺伝的、エピジェネティック、およびホルモンシグナルの相互作用が織りなす複雑なメカニズムを解明しました。
それは単にMAFの増幅という特定の遺伝子群のスイッチを入れるという単純なものではなく、転写因子のERαに直接的に働きかけ、エストロゲンというシグナルを利用してクロマチンの状態を変化させることで、転移に関連する遺伝子の発現が引き起こされるという極めて高次な制御機構でした。
この画期的な発見は、基礎生物学的な興味に留まらず、臨床応用への大きな可能性を提示します。MAF増幅を強力なバイオマーカーとして活用し、その下流で働くKDM1Aを標的とする治療戦略は、既存のホルモン療法や化学療法が効きにくい難治性乳がん患者にとって、新たな希望の光となるかもしれません。
がんの遺伝情報と、後天的に書き換えられるエピゲノム情報、そして生体内環境が織りなす複雑な相互作用を解き明かした本研究は、がんという難病を克服するための、未来の個別化医療に向けた重要なマイルストーンとなることでしょう。
参考文献
本記事はクリエイティブ・コモンズ・ライセンスCC BY 4.0のもとで下記の論文を参考にして作成しています。
Llorente, A., Blasco, M.T., Espuny, I. et al. MAF amplification licenses ERα through epigenetic remodelling to drive breast cancer metastasis. Nat Cell Biol 25, 1833–1847 (2023).
https://doi.org/10.1038/s41556-023-01281-y
関連アプリケーション紹介
上記の論文で記載されている実験手法に関連するツールをご紹介いたします。
分子間相互作用検出のための近接依存性標識 μMAP技術
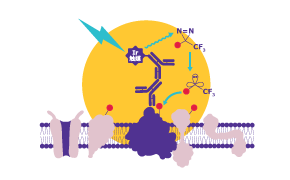
光触媒による近接標識技術(μMAP技術)を活用し、分子間相互作用を高精度に解析するためのキットをご用意しています。
標的のタンパク質に相互作用するタンパク質を標識するAtlasKit、および、標的の低分子化合物に相互作用するタンパク質を標識するHyasKitとDioneKitをご活用ください。
本キットによりビオチン標識されたタンパク質を精製し、LC/MSなどで解析することで相互作用するタンパク質を調べることができます。
技術解説カタログのダウンロード
クロマチン免疫沈降法(ChIP)
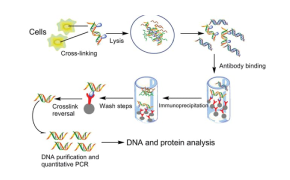
クロマチン免疫沈降法(ChIP)は、エピジェネティック研究において標的のタンパク質がゲノム上のどのDNA領域に結合するかを特定するために行われます。
適切なChIP抗体の選択は、ChIP実験の成功の鍵を握る最も重要なステップの1つです。ChIP抗体を選択する際に、いくつかの候補抗体を評価することをお勧めします。
ChIP法のワークフローと解説
エピジェネティクス研究用抗体の特集記事
プロテアーゼ阻害剤
ロシュ社が開発したプロテアーゼ阻害剤カクテルcOmplete™は、広範囲なタンパク質分解酵素に対応する阻害剤が含まれている錠剤で、目的のタンパク質を簡単に保護することができます。
タンパク質分解を抑止するためのゴールド スタンダードとして多くの研究者に愛用されています。
cOmpleteTMシリーズの製品と特長
関連ページ

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




