ヒトiPS細胞由来心筋細胞の創薬研究における有用性
iPS 再生医療だけではない。創薬研究にも有用。
ひとつの新しい薬を世に送り出すのは非常に困難なプロジェクト。創薬の過程に費やされる期間は一般的に10年以上かかるといわれており、その費用は数百億円かかるとされています。
このような状況を改善する方法のひとつとして期待されているのが、iPS細胞を用いた創薬研究です。様々な細胞に分化することができほぼ無限の増殖が可能なiPS細胞は、山中伸弥教授らによって2006年に樹立が報告されました。iPS細胞はよく知られている再生医療の分野だけでなく、創薬研究における活用にも期待が高まっています。iPS細胞から作り出したヒトの細胞を創薬プロセスに用いることで、プロセスの迅速化・高効率化が期待されるからです。
この記事では、iPS細胞由来心筋細胞の提供を行っているバイオベンチャー、株式会社マイオリッジの技術担当の方に、iPS細胞の創薬研究について解説していただきました。
創薬プロセスとヒトiPS細胞由来分化細胞
新薬候補として検討された化合物が市場に流通する確率は約3万分の1以下といわれています。それに加えて、最終的に新薬として承認されても、上市後に重篤な副作用が明らかとなり、販売中止になることもあります。
なぜ創薬にはこのような時間的・金銭的なコストを要するのでしょうか。それは、有効性と安全性の検討が不可欠であるからです。安全性の検討は、大きく分けて基礎研究、非臨床試験、臨床試験の3つの過程に分かれます(図1)。

図1. 創薬プロセスとiPS細胞の利用。各過程における研究項目と費やされる一般な年数。赤字はiPS細胞が貢献できるプロセス。
基礎研究では、薬剤のターゲットの選定や化合物探索が行われます。この過程の目的は、薬として効果のある化合物候補を絞り込むことです。続く非臨床試験では、薬による副作用がみられないかを、in vitro、 in vivo両方の試験が実施され、薬の安全性についての様々な評価が行われます。さらに臨床試験では、実際にヒトで薬の効果と副作用がみられるかどうかを調べることになります。
このようなプロセスを経ることで、新薬の価格は上がってしまいます。また、それだけでなく、これは医療経済を圧迫する一因となっています。近年、実験手法や周辺分析機器の技術革新は著しく、研究データも蓄積されてきていますが、それでも依然、薬の開発に莫大な資金と時間が費やされる状況は変化していません。
ヒトiPS細胞由来細胞を用いた治療薬探索
新たな医薬品をつくるためには、新規の創薬ターゲットを探索することから始めなければなりません。化合物の探索を行う方法としては、ヒトを含む動物細胞を用いた表現型スクリーニングがよく用いられます。本当は人に投与する薬剤なので、動物細胞よりは種間差のないヒト細胞を用いて実験する方が望ましいのです が、ヒトプライマリ細胞を大量かつ、安定的に用意することはなかなか困難でした。
しかし、iPS細胞技術なら、ヒトプライマリ細胞に近い性質の細胞を大量に用意することができます。これは非常に画期的な技術であり、薬効のある薬剤を発見する確度や効率を改善できると考えられています。実際に、疾患iPS細胞と健常者の細胞を比較することで、病態を改善するターゲットを絞り込むスクリーニングなどに活用することが期待されています。
ただし、iPS細胞由来分化細胞を化合物探索に用いる場合には、次のような課題があります。
- 細胞の安定供給システムの構築
- ロット間差の少ない細胞の作成
- 成人型に近い細胞の作成
- ハイスループット評価系の構築
これらの課題を解決するために、マイオリッジでは、低分子化合物を用いたiPS細胞由来心筋細胞の分化誘導法を開発しました。この手法を用いることで、完全なタンパク質フリーで分化誘導をすることができます。また、ロット間の差が小さい大量の心筋細胞を作製することが可能になりました。
さらに、得られる細胞も成熟度が高いことも特徴の一つです。組織浸透性の高い低分子化合物を用いて細胞塊状態での心筋細胞誘導法を行うことで、整列したサルコメア構造がしっかり観察される細胞になっています。先に述べた①、②,③の課題に対応した細胞になっているのです。
近年、iPS細胞由来心筋細胞を用いた心疾患病態モデルが相次いで報告されています(表1)。
表1 iPS細胞由来心筋を用いた疾患モデルの報告例
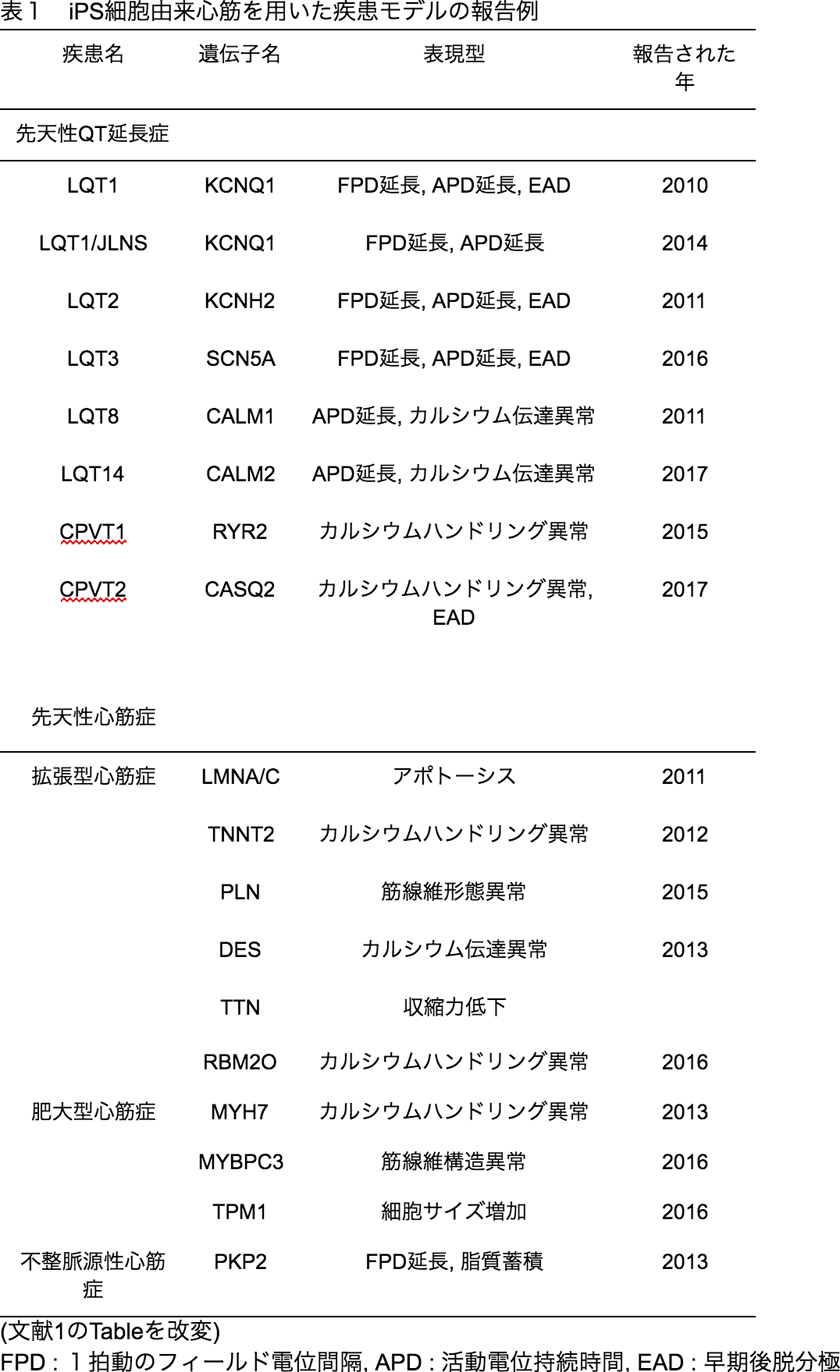
これらの論文では、心筋細胞の機能の評価方法として、画像処理による細胞構造と収縮能評価や、膜電位測定、カルシウムシグナリング測定、ミトコンドリア活性測定などが行われているとともに、ハイスループット評価系を見据えた96ウェルプレートでの解析が可能となっています。
iPS細胞由来心筋のスクリーニングから新薬の候補が見つかったとの公の例はまだありませんが、近い将来にそのような報告がなされることが期待されています。
安全性評価試験の予測向上にiPS細胞を利用する
新薬開発における重要な試験の一つに、心毒性の評価があります。心毒性の評価は、基礎研究で医薬品候補化合物が見つかったあとに、前臨床試験の中で行われます。
図2で示したのは、WITHDRAWN のデータベースに挙げられている、心毒性により市場から撤退してしまった薬です。様々な組織への薬のオフターゲットとして心毒性が検出されていることが分かります。
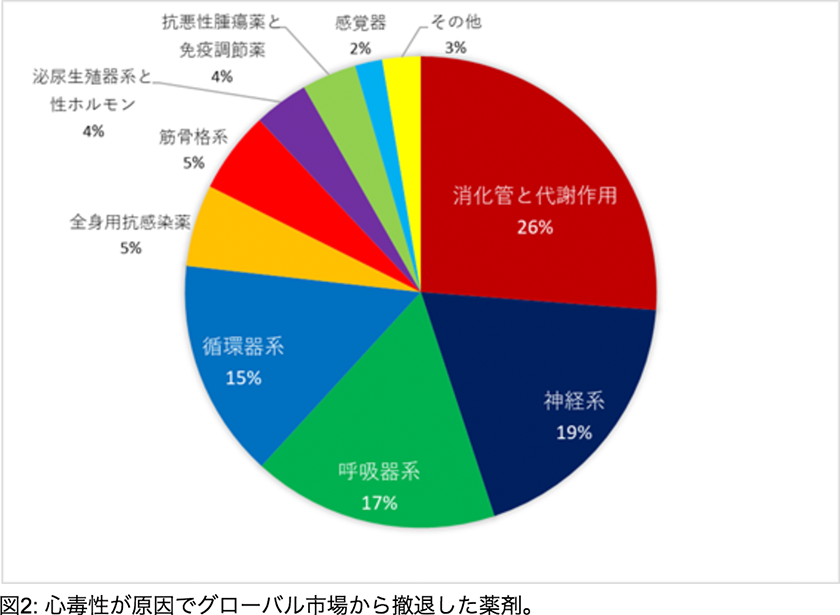
1964-2011年の間に心毒性を理由として撤退した48種類の薬剤を、解剖治療化学分類法(ATC分類)に従って分類した。
現在、心毒性評価には、動物試験や、「hERG試験」と呼ばれるカリウム電流(hERGチャネル)阻害作用試験が行われていますが、動物試験は、心拍数や活動電位のパターン、代謝経路がヒトとは異なるところが欠点です。また、試験のためには合成量も多く準備する必要があります。
一方、hERG試験にもいくつかの問題点があります。hERG試験は、心筋にあるカリウムチャネルを強制発現した動物細胞などを用いて、化合物がQT延長作用を示すかどうかを検出する試験です。この試験では、偽陽性が多く有用な候補化合物を脱落させてしまうケースがみられることが問題点として挙げられます。また、心毒性の中でもTdP(トルサデポアン)とよばれる重篤な不整脈を起こし突然死にいたる毒性を検出できないことも欠点です。
以上のことから、心毒性の評価には、動物試験やhERG試験に代わるより精度の高い方法が求められています。
これらの課題を解決する方法として、ヒトiPS細胞由来心筋細胞を安全性試験に用いることが検討されています。iPS細胞心筋では、マルチイオンチャンネルが発現されており、hERGチャネルだけの作用をみるよりも精度が上がると考えられるためです。現在、iPS細胞心筋を用いた安全性評価法の開発と国際基準標準化に向けた取り組みを、複数の研究所や企業の研究者が協力して行っています。
iPS細胞由来心筋細胞を用いた安全性評価法開発の一例では、既存の60化合物についての大規模検証実験が行われました。この研究では、TdPの発生リスクなどについて臨床データベースと比較すると80 %以上で結果が一致したと報告されました。iPS細胞心筋の高い予測性が示されるなど、期待のできる結果が報告されはじめています。(文献2)。
今後、iPS細胞心筋を安全性試験で用いるようになれば、安全性試験の精度が向上し、試験の効率化が進み、創薬プロセスの迅速化、高効率化が進みます。大きな可能性を秘めたiPS細胞を用いた新薬開発の今後にますます期待が高まります。
(この記事は、許可を得て、株式会社マイオリッジ 石田賢太郎氏、末田伸一氏、庄司和磨氏による解説を元にしています)
参考文献
- Brandão, O. K. et al. Human pluripotent stem cell models of cardiac disease: from mechanisms to therapies. Dis Model Mech. 10, 1039–1059 (2017).
- Yamamoto, W. et al. A new paradigm for drug-induced torsadogenic risk assessment using human iPS cell-derived cardiomyocytes J Pharmacol Toxicol Methods. 84, 111–127 (2017).

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




