医薬品の元素不純物ガイドラインと分析のための認証標準物質

元素不純物の混入レベルを管理するために
医薬品への金属の混入は「元素不純物」と呼ばれ、いくつもの汚染源から発生します。医薬品の合成時に意図的に添加される場合や、製造装置との相互作用や医薬品の成分として意図せず混入してしまう場合があり、最終的に製剤中で検出されてしまいます。元素不純物はその毒性により患者の健康に危害を及ぼすため、混入レベルを許容限度内に管理しましょう。
本記事では、医薬品の元素不純物ガイドラインと分析のための認証標準物質について解説します。
ICH Q3Dガイドラインにおける元素不純物の分類
2009年、医薬品規制調和国際会議(ICH)は、医薬品および原料中の金属不純物を制限するため、国際的に調和のとれたガイドラインを策定することを提案しました。このアプローチで、元素不純物の制限に関する明確なガイドラインが全世界に提供されたため、各国規制当局には大きな影響があり、たとえ国や地域が異なっても透明性のある同じ結果に導かれる状況になりました。
ICHはステップ4の「元素不純物ガイドライン」の中で、リスクアセスメントプロセスにおける意思決定を容易にすることを目指し、元素不純物を4つのクラスに分類しました。ひとつずつ見ていきましょう。
クラス1
これらの不純物はヒトに著しい毒性を持つため、医薬品製造での利用が制限または禁止されます。広く用いられる材料(採掘賦形剤など)からの不純物として見つかることも。クラス1に含まれる4元素はすべて、潜在的なあらゆる混入源と投与経路でリスクアセスメントによる評価を実施しましょう。
クラス1元素は、As、Cd、Hg、およびPbが該当します。
クラス2
この不純物は一般的に、投与経路に依存してヒトへの毒性を発現すると考えられています。医薬品への相対的な混入しやすさに基づき、2つのサブクラス2Aと2Bに分類されます。
- クラス2A 医薬品に混入する可能性が比較的高いため、潜在的なあらゆる混入源と投与経路全体でリスクアセスメントが必要です。
クラス2A元素は、Co、Ni、および Vが該当します。 - クラス2B 天然の存在量が少なく、他の材料から遊離される可能性が低いため、医薬品に混入する可能性が低いものです。そのため、医薬品の原料、賦形剤またはその他の成分の製造中に意図的に加えない限り、リスクアセスメントの対象から除外されます。
クラス3
この元素は経口投与では比較的毒性が低いものの、吸入または非経口ルートで投与する場合はリスクアセスメントが必要になることがあります。
クラス3元素は、Ba、Cr、Cu、Li、Mo、Sb、およびSnが該当します。
その他の元素
毒性が低いため、および/または各国で規制が異なるため許容1日最大曝露量(PDE値)が定められていない元素不純物がいくつかあります。これらの元素が医薬品中に存在する場合は、他のガイドラインおよび/またはその国・地域の規制により取り扱われます。
この元素はAl、B、Ca、Fe、K、Mg、Mn、Na、W、およびZnが該当します。
米国薬局方(USP)と欧州薬局方(EP)の元素不純物ガイドライン
2010年まで、USPとEPにおける医薬品の元素不純物(重金属による汚染)の確認手法には金属硫化物の沈殿と鉛標準品との比較による比色法が定められていました。(USP <231>およびPh.Eur. 2.4.8)その後現在までに、各薬局方においてICH Q3Dガイドラインに従った改定が行われています。
USP改定の流れ
USPはICHが2010年に発行した元素不純物ガイドライン(Q3D)に基づいて、不純物の制限、医薬品と原料の分析工程、および栄養補助食品中の元素汚染物質をカバーする3つの新しいGeneral Chapterを提案しました。
- Chapter USP <232>:Ph.Eur. 5.20:医薬品中の元素不純物‐制限
- Chapter USP <233>: 医薬品中の元素不純物‐手順
- Chapter USP<2232>: 栄養補助食品中の元素汚染物質
USPは2018年1月1日をGeneral Chapter <232>、<233>、および<2232>の施行日と定めており、以降は新規に申請する医薬品、既存の医薬品共にガイドラインに従う必要があります。この実施は、2014年12月16日にアナウンスされたICH Q3Dステップ4元素不純物ガイドラインの内容に合わせ、別の医薬品・医療機関が定めたタイムラインと一致しているものです。
EP改定の流れ
EPは、2014年7月に元素不純物に関する戦略とICH Q3Dの実施に関する計画をアナウンスし、それからほぼ1年後の2015年4月に元素不純物に関する方針とGeneral text、Individual textの改版スケジュールを発表しました。同年8月には、ICH Q3Dの適用範囲から外す医薬品を明確化。2016年6月以降は、新規医薬品またはすでに承認された医薬品のいずれかを含有する新たに製造承認を得る製品に関してこのガイドラインが適用されています。また既存の医薬品(すでに承認された医薬品の新しい相互承認申請を含む)についても、2017年12月からガイドラインに従う必要があります。
ICHの原則により、金属触媒と金属試薬に関するEMAガイドラインが、General Test 5.20とGeneral Method 2.4.20に置き換えられました。2018年1月1日に実施されるPh.Eur. Suppl. 9.3では、天然由来の物質を除いて、個々のモノグラフに元素不純物の試験はありません。元素不純物固有の性質から考えれば、医薬品中に混入しうる元素汚染源のほとんどは天然由来の物質であると考えられるからです。EP当局は、PDE値が定められていない元素(ICH Q3Dガイドラインで「その他の元素」に分類された元素)に関して、別途試験を実施することも推奨しています。
日本国内の流れ
2015年9月30日、厚生労働省医薬食品局審査管理課長通知(薬食審査発0930第4号)として「医薬品の元素不純物ガイドラインについて」が発出され、日本国内においてもICHQ3Dが施行されることとなりました。
本ガイドラインは、2017年4月1日以降に承認申請される新医薬品のみ適用されていましたが、2021年6月 公示予定の第十八改正日本薬局方で、 2.66 元素不純物および新規通則34において既存の製剤においても適用されることとなりました。
元素不純物の分析方法
ICH は規制のグローバルの調和を図ることを目的とした機関であるため、元素不純物分析のための機器分析法を特に推奨してはいませんが、USP <233>では製剤または成分に含まれる元素不純物の推定濃度に応じて以下の分析手法を提案しています。
- ppmオーダーの場合:ICP-OESまたは原子吸光
- ppbオーダーの場合:ICP-MS
また日本薬局方の従来の試験法は重金属試験法およびヒ素試験法ですが、2012年10月、第16改正日本薬局方第一追補よりICP-AES、ICP-MSが一般試験法として収載されています。
元素不純物に対するICH Q3Dの制限
全24元素に対し、3つの主な投与経路に応じて毒性限度値がPDF値(permitted daily exposure:1 日に許容される摂取限度値、単位:mg/day)として定められています。表1に、1日の服用量が10 g以下の医薬品に適用されるPDE値を示します。
表1 元素不純物に対する許容1日曝露量(PDE値)
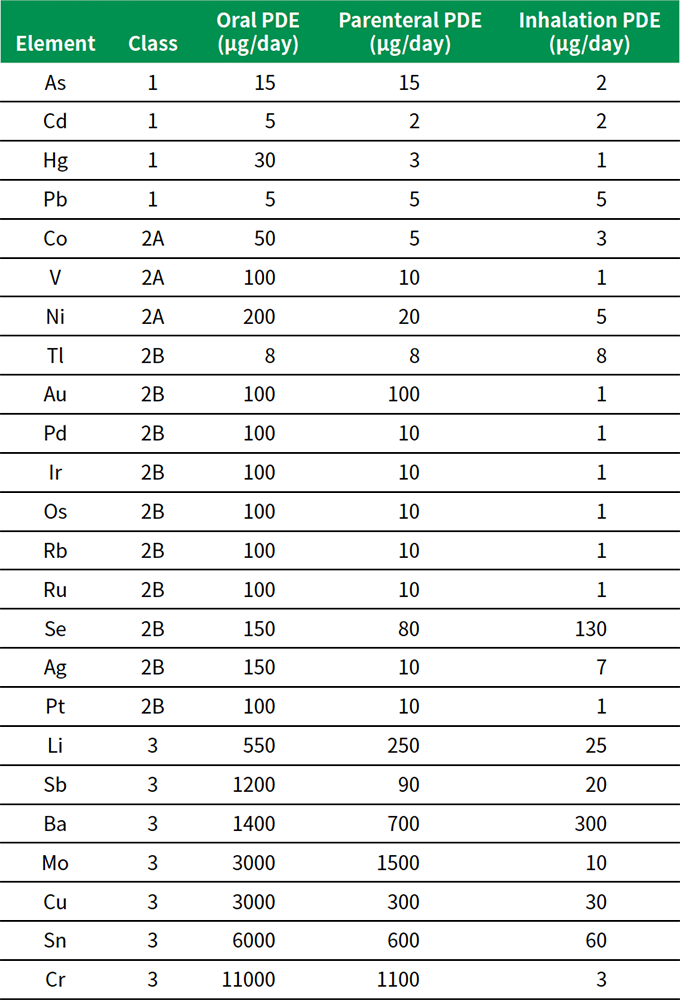
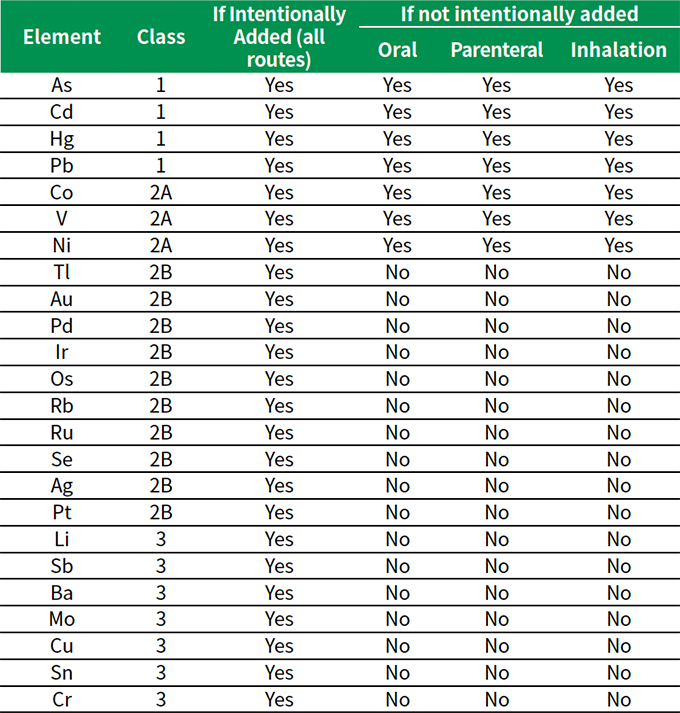
表2に、リスクアセスメントで検討すべき元素を挙げました。
表2. リスクアセスメントで評価すべき元素
Q3Dガイドラインに適合したICP用標準物質
Q3Dガイドラインに従った元素不純物分析では複数元素を同時に分析する必要があり、その元素の組み合わせも決まってきます。このようなケースでは、すでに目的の組成で混合されている標準品を用いることで、シングルエレメントスタンダードを用いる場合と比較して以下のメリットがあります。
- 混合調整する作業時間の削減
- コストの削減(シングルエレメントスタンダードを買い揃えるよりも低コスト)
- 正確で再現性の高い分析の実現
混合調整する作業は時間がかかり、手技に依存してデータがばらつくリスクもありますので、適切な試薬を用いることをおすすめします。
シグマアルドリッチは、元素比がICH Q3DガイドラインのPDE値に対応している元素混合標準品TraceCERT®を提供しています。standard Iはクラス1、2A、および2Bの元素の一部を含む混合物、standard IIはIに含まれていないクラス2Bの元素を、standard IIIはクラス3元素をすべて含みます。
以下にTraceCERT®の各製品に含まれる元素濃度(mg/L)をまとめました。TraceCERT®について詳細をお求めの場合は、こちらをご覧ください。
<カタログ>
TraceCERTカタログ請求


下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須