<詳細解説>薄層クロマトグラフィー(TLC)の基本と原理

低コストで手軽な薄層クロマトグラフィーを使いこなそう
液体クロマトグラフィーの一種である薄層クロマトグラフィー(以下、TLC)は、低コストで手軽な分析方法です。現在、医薬品の純度試験や合成実験の追跡確認試験など、様々な分野で使用されています。近年では、TLCと質量分析装置(MS)を組み合わせたTLC-MSも開発され、技術の広がりも見せています。
TLCは手軽な手法ですが、だからといって油断は禁物です。手作業で行うTLCは、実験環境に影響を受けやすく、実験操作についての基礎知識と実験者の経験も必要です。この記事でTLCの原理と特長を理解し、基本を押さえて実験を行いましょう。
TLCを利用する5つのメリット
TLCには次のような5つの特長があります。
- 多検体を迅速に分離可能
高速液体クロマトグラフィー(HPLC)では、1本のカラムに対して1サンプルずつしか分析できませんが、TLCはプレート表面に複数サンプルをのせることで、同じ展開溶媒で同時に分析可能です。高分離能プレートを用いれば最大72サンプルを1枚のプレートで分析でき、1回の分析時間は数10分~1時間程度で済みます。標準品との比較や多検体の試験を行うときにはTLCが適しています。 - 高価な機器や高度な技術が不要
高価な装置が不要なこともTLCの大きなメリットです。ガラス製展開槽とTLCプレートおよび試薬があれば実施できるため、初期投資を抑えることができます。特に難しい実験操作もないので、初心者でも手軽に始められます。 - 汎用性の広さ
TLCの担体で一般的によく使われているのはシリカゲルですが、他にもアルキル鎖などを化学修飾したシリカゲルや酸化アルミニウム、セルロースなど、分析したい物質の特性に合わせた多様なプレートが販売されています。分離後に呈色反応を利用することでほとんどの化合物を検出することができるため、分析したい物質の特性に合わせて検出器を用意する必要がなく、汎用性の広い優れた手法といえるでしょう。 - 測定試料の精製や前処理が不要
TLCプレートは使い捨てです。繰り返し使用するHPLCカラムは、目詰まりや汚染によるカラムの劣化が起こります。そのため、次の分析への影響を防ぐためにシステムやカラムの洗浄を行い、厳密な試料前処理などの操作が必要になりますが、TLCはそれらの処理がいらないことから、夾雑物が多く含まれるサンプルの分析に適しています。 - 分析結果が理解しやすい
TLCでは、一枚のプレート上にすべての分析結果が残ります。目視で結果が確認できるため、分離の様子を直感的に理解しやすいこともメリットの1つです。たとえば分離不良だった場合にも、原点にサンプルが残っているのか、またはバンドが重なったまま移動しているのかなど、結果を見れば一目瞭然です。HPLCの場合は、ピークが検出されなかった場合に多数の要因を考慮する必要があります。カラム内に蓄積しているのか、すべてが溶出してしまった後なのか、システムの不具合なのか、パッと見ただけではわからないからです。一方、TLCではその心配がないため、分析の条件検討にも最適な手法といえるでしょう。
次にTLCの実験方法と原理について具体的に説明していきます。
TLCの実験の流れ
TLCでは、ガラス板やアルミシートなどの表面にアルミナやシリカゲルなどを塗布した薄層板(TLCプレート)を使用します。このとき塗布したアルミナやシリカゲルを担体、ガラス板やアルミは担体を支える支持体と呼びます。
まず始めに、TLCプレートの担体表面の端にガラスキャピラリーなどを用いて試料溶液をのせ、乾燥させます。次に試料をのせたTLCプレートの下端を展開溶媒(移動相)に浸します。図1のように展開溶媒を入れたガラス製展開槽に、担体が塗布された側を上に向けて立てかけるように入れます。
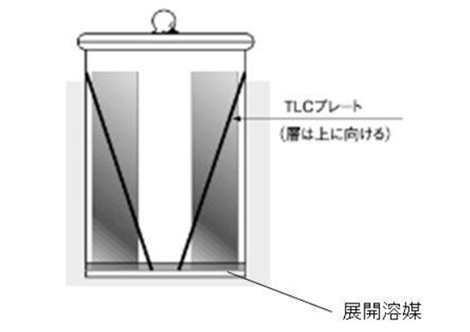
図1 TLC用展開槽の使用方法
溶媒は毛細管現象によって担体に浸み込み上昇していき、展開が開始されます。試料は、固定相と移動相との間の相互作用の違いによって成分ごとに異なる速度で移動相と共に上昇していき、ある程度上昇すると、TLCプレート上に分離された化合物がバンド状に残ります。色の付いたスポットは目視で確認、色がないスポットはあらかじめ担体に蛍光指示薬を添加しおくことで、UVランプ照射により確認することができます。また、分析したい物質に合わせた呈色反応で検出することもできます。
TLCの原理
TLCの原理は基本的には液体クロマトグラフィーと同じです。TLCの溶媒が上昇していく過程で試料の中に含まれる化合物が分離されていきます。このとき、化合物は、固定相(塗布されたアルミナやシリカゲル)と移動相(展開溶媒)の間で吸着と脱離を繰り返しています。
図2にその様子を模式図で示しました。
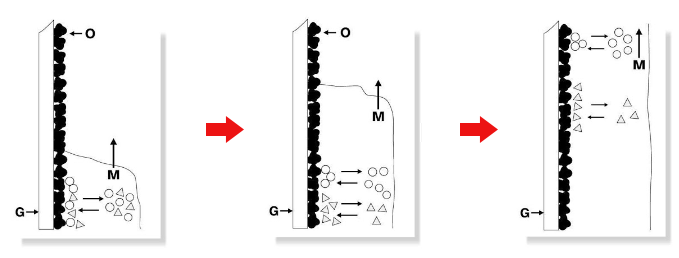
図2.TLCの分離原理:吸着
G=担体層の支持体(ガラスプレート)
O=固定相表面
M=移動相
S=固定相液体
Gは支持体(ガラスプレート)で、この上に担体(固定相)Oが塗布されています。移動相Mが下から上昇していくと、固定相Oの表面に吸着していた化合物が移動相に溶解して固定相から脱離し、一緒に上昇します。移動の途中で再び固定相に吸着し、また脱離するというプロセスを繰り返すことで吸着しやすさの差が移動の速度に反映され、〇と△の化合物が分離されます。
さらに、TLCプレートの種類によっては、溶媒が2相に別れる現象が生じます。この場合は吸着だけでなく、「分配」というプロセスを考える必要があります。分配がおきやすい例として、水または水性混合物などの極性溶媒をセルロースのような親水性の担体に保持させ、極性の低い溶媒を移動相として用いた場合があげられます。
図3にTLCの分配の様子を模式図で示しました。
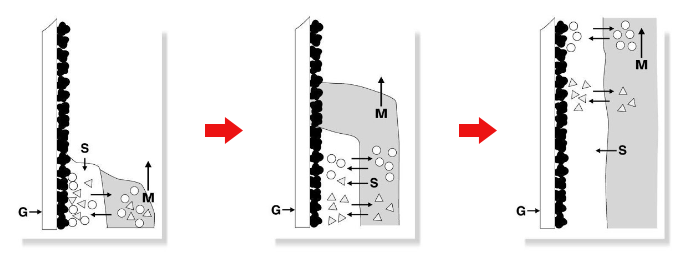
図3.TLCの分離原理:分配
G=担体層の支持体(ガラスプレート)
O=固定相表面
M=移動相
S=固定相液体
移動相の一部が担体表面に吸着し、移動する液相と混じり合わない相ができた場合、この吸着した担体の層を「固定相液体」と呼びます。図3のSが固定相液体です。試料の成分は固定相と移動相の吸着と脱着だけでなく、この2つの液相間を行き来しながら上昇していきます。このプロセスが分配です。
このとき2相への溶解度の差によって速度が変化し、分離が行われます。固定相液体に分配しやすい物質ほど、移動速度が遅くなります。
吸着プロセスは、極性の異なる化合物(エステル、アルコール、酸)の分離や、固定相との相互作用エネルギーに差がある構造異性体の分離に適しています。一方分配プロセスは、例えば同族体(すなわち脂肪酸)など溶解度の異なる物質の分離に役立ちます。ほとんどの系では、吸着プロセスと分配プロセスが両方同時に起こります。
TLCの結果を評価するRf値の求め方
試料をTLCで分離した結果は、Rf値を求めて評価します。Rf値(Relative to front)は、溶媒の移動距離と、求めたい物質の移動距離の相対値です。
図4にRf値の求め方を図示しました。
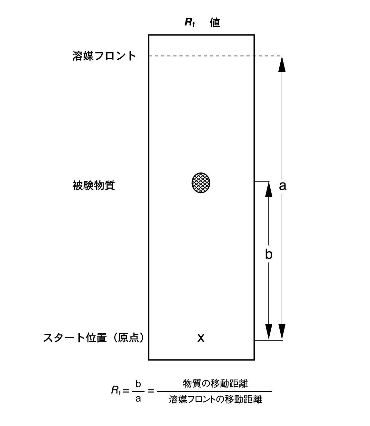
図4 Rf値の求め方
溶媒が最終的に到達した位置を「溶媒フロント」と呼びます。スタート位置から溶媒フロントまでの距離aが、溶媒の移動距離です。物質の移動距離bは、スタート位置から1つのバンドの中で最も濃度の濃い位置までの距離です。物質の移動距離bを溶媒の移動距離aで割ると、Rf値が求められます。TLC実験では物質の移動に影響を及ぼす要因は数多くあり、これらを制御することは困難なため、Rf値は近似値とみなされます。
以上、TLCの基本と原理について解説しました。メルクのサイトには、動画セミナー「薄層クロマトグラフィー(TLC)の基礎~実験操作のポイントとトラブルシューティング~」や、TLC製品についての専用ページもありますので、ぜひ実験に役立ててください。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須