「キャピラリーガスクロマトグラフィー」とは

クロマトグラフィーの歴史と発展
クロマトグラフィーは、気体、液体、超臨界流体を移動相とし、カラムと呼ばれる管の中に充填された固定相と物質の相互作用によって混合物を分離・検出する分析法です。クロマトグラフはライフサイエンスの研究でも身近なものですが、その起源は諸説あります。
その一つが、1900年にアメリカの化学者D.T.Dayが行った「石灰石カラムを用いた原油分離の実験」を起源とする説。しかし、より一般的なものは次の説とされています。それは、ロシアの植物学者Mikhail Tswettが1903年に行った「石灰カラムでの石油エーテルを用いた植物色素の分離」を起源とするものです。ギリシャ語の「chrom(色)」と「graph(描く)」を合わせ、Tswettによって命名されました。
液体クロマトグラフィーとガスクロマトグラフィーの比較
液体クロマトグラフィー(以下、LC)では移動相に液体を使用しますが、ガスクロマトグラフィー(以下、GC)では移動相にガスを使用します。移動相の違いは分離や溶出に影響を与えますが、基本的原理は同じです。GCとLCの大まかな違いを表1にまとめました。
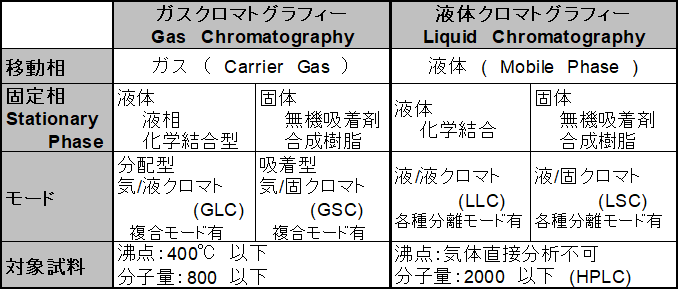
表1 ガスクロマトグラフィーと液体クロマトグラフィー
GCでは装置に導入した化学物質を高い温度で気化し、あらかじめ成分の分かっている移動相のキャリアガスと共に気体としてカラムに導入します。一方、LCでは化学物質を溶離液に溶かしてカラムに導入します。LCは試料を気化させる必要がないため、イオン交換GCやサイズ排除GCより多くの分離モードを選択できます。そのためGCに比べ広い範囲の化合物分離に適用可能です。
LCは高速液体クロマトグラフ(HPLC)の登場によって分離効率も飛躍的に向上しました。しかし、キャピラリーGCに比べてカラム1本当たりの理論段数が低く、微量多成分一斉分析ではGCを超えることができません。
ガスクロマトグラフィーの仕組み
クロマトグラフィーは、一定条件下の場(定常場)において、混合試料を移動相に溶解させた状態で通過させ、試料を分離させます。試料が移動相とともに通過する場には、試料と相互作用を行う固定相が存在しています。つまり、対象とする試料は「移動相」によって運ばれ、試料中の各成分は「固定相」との相互作用により、物質ごとあるいは類似したグループごとに分かれて場から出ていくのです。
これをGCに置き換えると以下のようになります。
- 定常場=GC装置、カラム
- 移動相=キャリアガス(ヘリウム、窒素などの不活性ガスや水素)
- 固定相=カラム充填剤、液相
図1はカラム内での物質の保持と分離の様子を示しています。混合試料はカラムを通過するにしたがって、試料を構成する物質がそれぞれの性質によって固定相と異なる強さの相互作用を受け、各物質に分離していきます。
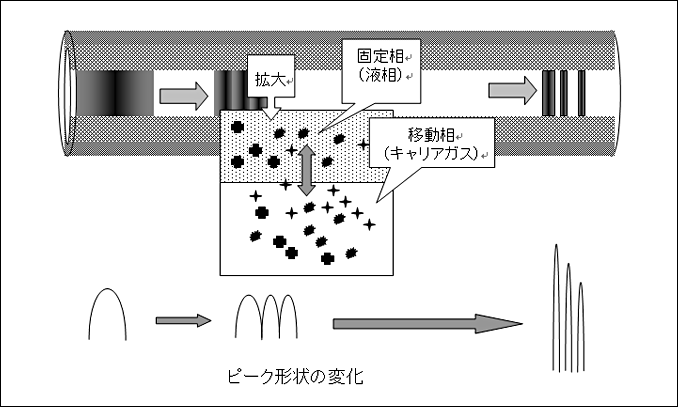
図1 カラム内での物質の保持と分離
GCの場合、試料は気化した状態でキャリアガスに溶解、カラム内を通過していき、キャリアガスとカラム内の固定相間で吸着、あるいは分配作用を受けます。吸着作用は分子間引力や固体表面の極性などによって構成され、分配作用は分散力と電子作用(双極子による配向効果、誘起効果など)、水素結合などによって構成されます。
ガスクロマトグラフィーの担体の種類
GCでは大きく分けて2種類のカラムが使われます。管の中に充填剤を詰めた充填カラム(パックドカラム)と、中空の管の内壁に固定相を塗布したキャピラリーカラムです。
さらに、カラムの種類と適合試料は、吸着型(GSC)、吸着/分配型(GSLC)、分配型(GLC)の3つのモードがあり、表2のように分類できます。
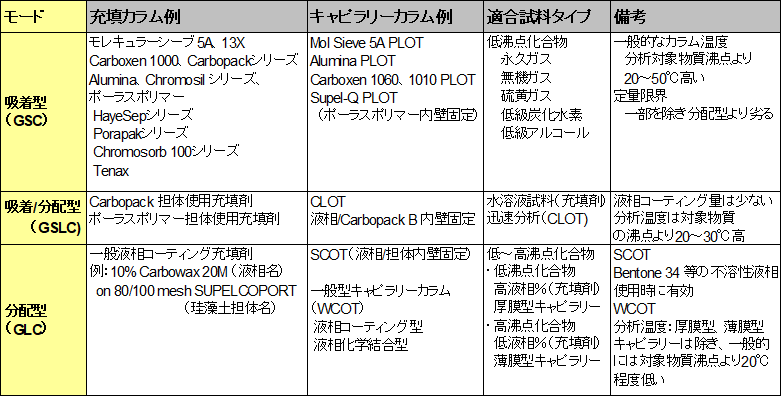
表2 ガスクロマトグラフィーカラムのタイプと適合試料
キャピラリーカラムが持つ優れた2つの特長
キャピラリーカラムは充填カラムに比べて、①高い分離能力と②高い不活性度という特長があり、幅広い分野で使われています。
キャピラリーカラムの2つの特長について、充填カラムと比較しながら詳しく解説します。
-
キャピラリーカラムの高い分離能力
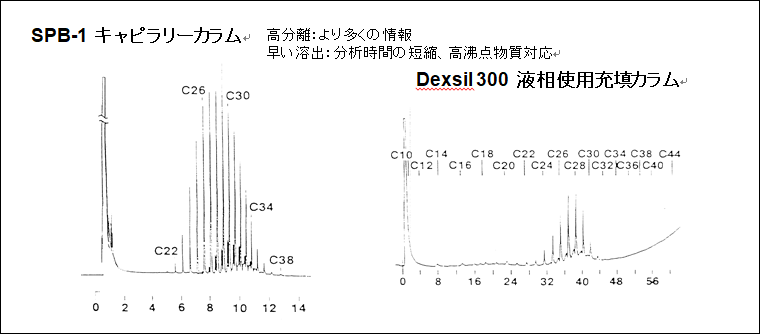
図2は、キャピラリーカラムと充填カラムの分離能力をワックス試料で比較した結果を示しています。

図2 キャピラリーカラムと充填カラムによるワックス試料分離比較
キャピラリーカラムによる分析では、側鎖と思われるピークが炭化水素の各ピークに近接して確認できています。一方、充填カラムによる分析では、こうしたピークが確認できません。また、キャピラリーカラム分析ではC38の炭化水素溶出までの時間がわずか12分程度ですが、充填カラム分析では50分ほどを要しています。
このワックス試料分離比較から、キャピラリーカラムによる分析は、充填カラムに比べ優れたピーク形状、高い分離性能が得られること、そのため試料のより詳細な情報が得られること、より早い時間での分離が可能であることがわかります。
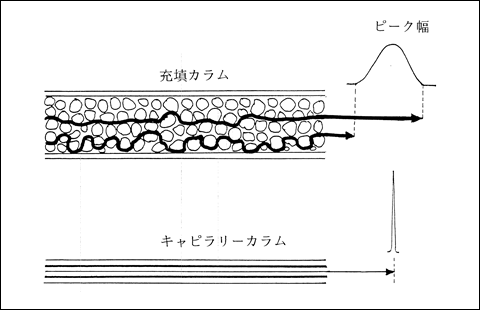
では、なぜキャピラリーカラムのほうが分離能力が優れているのでしょうか。それは、カラム内が中空だからです。図3に示すように、充填カラムでは注入された試料は充填剤の空隙を通過し、多流路となります。そのため、同一試料にもかかわらず通過時間に差が生じます。これがピーク幅が生まれる要因になるのです。一方、キャピラリーカラムは単一の流路となります。

図3 GCカラム内の試料流路
-
キャピラリーカラムの高い不活性度
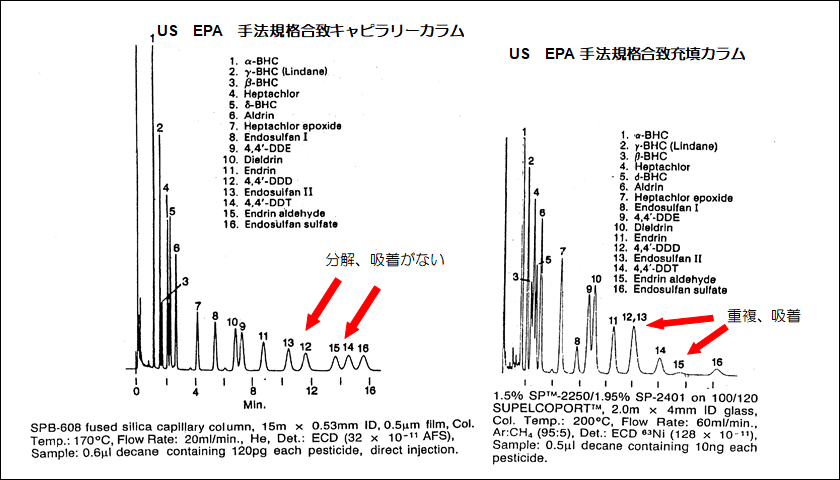
図4は、以下の分析条件で実験を行ったキャピラリーカラムと充填カラムによる農薬分析の結果を示しています。
<分析条件>
・GCは同じ充填カラム仕様の装置を使用
・キャピラリーカラムへのキャリアガス流速は20mL/min
・分析時のカラム温度は恒温
・キャピラリーカラムへの試料注入量は各成分0.12ng
・充填カラムへの試料注入量は10ng(キャピラリーカラムの約83倍相当)
図4 キャピラリーカラムと充填カラムによる農薬分析
図4を見ると、キャピラリーカラムでの各農薬の分離やピーク形状は充填カラムに比べ全体として極めて良好であることがわかります。比較試験に使用した充填カラムの不活性さはUS EPA手法で定められた規格を十分に達成しているにもかかわらず、エンドリンアルデヒドのピークは他の農薬と比べピーク強度が低下しています。一方、キャピラリーカラムではこの傾向は見られません。
この結果は、キャピラリーカラムが充填カラムに比べてさらに不活性で、試料物質の吸着や分解などが少ないことを示しています。
キャピラリーカラムの不活性さの要因は、使用している溶融シリカに不純物が少なく、しかも活性基の存在自体が少なく不活性化を行ないやすい点にあります。一方、充填カラムは使用している担体の不活性化を極限まで行なっても溶融シリカの不活性さには及ばないため、特定の物質では、吸着や触媒作用による分解を起こしてしまうのです。
以上、クロマトグラフィーの基礎からキャピラリーカラムの優位性について紹介しました。一斉分析や極微量分析を行う際にに、キャピラリーGCの導入を検討してみてください。

下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須