阻害剤マスターの道!酵素反応の実験系を正しく構築するには

酵素反応の実験系を構築するときの注意点とは
生化学的な酵素反応を定量するときは、さまざまな条件を考慮して実験系を構築します。特に最大反応速度の測定には、反応系内の最初期反応を正確に観察できる条件設定が必須です。信頼度の高い酵素反応の定量を行う方法の1つが阻害剤の利用です。
酵素反応の実験系で阻害剤を用いるときは、以下の点に気をつけましょう。
- 実験に必要な阻害剤の量
- 阻害剤添加のタイミング
- 反応停止方法
- pH変化・反応産物の安定性
この記事では、上記のポイントについて詳しく解説していきます。
実験に必要な阻害剤の量は慎重に決定しよう
サンプルの種類や調整法によって、阻害剤を選択するときの検討項目は変わってきます。例えば、阻害剤の濃度や量が過剰な場合、阻害効果が全く得られなかったり、逆反応が起きたりすることも。正しいコントロールデータを取り、実験データを常に補正することを徹底しましょう。
実験に必要な阻害剤の量は、使用する細胞種、透過性、処理時間など複数の要因で決まります。阻害剤の初期濃度を決定する方法として最も効果的なのが文献調査です。KiやIC50の数値情報が既知であれば、その5~10倍量を使用すると活性を完全に抑制できるでしょう。KiやIC50が未知の場合は、まず十分広いレンジの濃度で阻害剤を作用させ、ミカエリス-メンテンの関係からKiを算出します。
阻害剤の濃度を決定するには、酵素反応に関する基本的な理解が必要です。以下、よく用いられる阻害剤関連パラメーターを記載します。
- EC50 最大の薬理効果を示す作用量の50%の量を示す値。創薬の現場で用いられることが多い。
- ED50 試験に用いた動物などの半数が特定の量的効果を示す値。
- IC50 50%の阻害効果を発揮するために必要な薬剤濃度。
- Ki ミカエリス-メンテンの関係を用いて測定される、50%の阻害効果が観察される阻害剤濃度。
- Kd 2種またはそれ以上の分子種によって構成される複合体から、特定の分子が乖離する程度を示す平衡定数(乖離定数)。
さらに詳しく知りたい人は「基本を学ぶ。酵素と阻害剤の反応速度論」も参照してください。
阻害剤添加のタイミングで反応が変わることを意識しよう
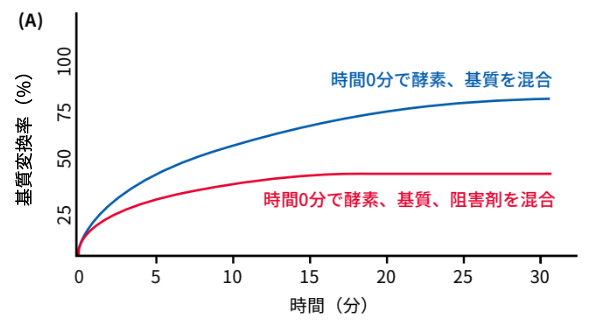
実験結果の解釈に関わるため、阻害剤を添加するタイミングと処理時間は重要です。図(A)は、「時間0分の時点で酵素、基質、阻害剤が同時に混合された場合」の反応を示しています。青の曲線は阻害剤を添加していないときのコントロールで、赤の曲線は時間0分で阻害剤を添加した結果です。阻害剤を加えると基質転換率が低下し、約15分経つと一定値になる様子がわかります。
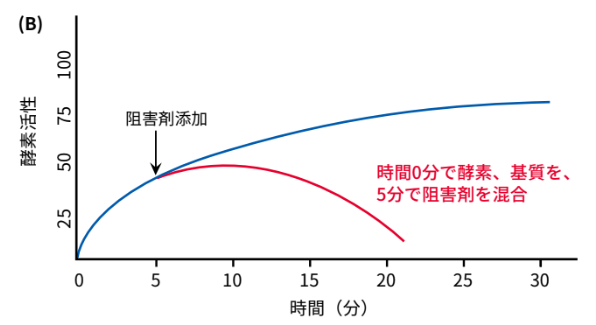
次に「酵素と基質を混合した5分後に阻害剤を添加した場合」を図(B)に示します。この場合、阻害剤を加えた時点から酵素反応速度が低下します。図を見ると、図(A)とは異なる反応を示していることがわかります。これは、0〜5分の間にすでに酵素反応が進行し最終産物が生じているからです。
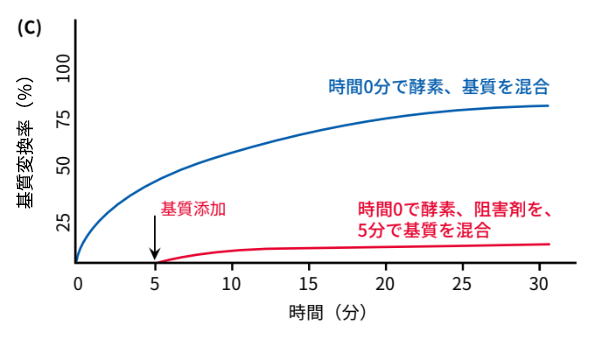
では、「時間0分で酵素と阻害剤を混合し、5分後に基質を添加した場合」はどうなるでしょうか。その結果を図(C)に示します。この場合、阻害剤によって酵素の反応がすでに抑えられているため、基質と酵素の反応がほとんど起こらず、以下の図のような結果になります。
このように、最終産物の量は阻害剤の添加のタイミングで変わります。酵素、基質、阻害剤の組み合わせが同じでも、3通りの方法からは全く異なる結果が生じるのです。以上をしっかりと意識して、目的に合った実験系を検討しましょう。
実験条件に合った反応停止方法を選ぼう
精度の高い実験を行うためには、反応時間を正確に制御することが重要です。特に、複数のサンプルを同時に処理しデータも同時に取得したいときは、酵素反応を同時に停止させる工夫が必要になります。処理時間に差が出てしまうと、実験結果に誤差が生じてしまうからです。
反応の停止方法を選ぶときは、反応産物が最終的にどのように分析されるかを考慮します。酵素反応の停止には過塩素酸(Perchloric acid: PCA)やトリクロロ酢酸(TCA)がよく利用されますが、酸が下流の測定を阻害する場合には、中和処理が必須です。しかし、アルカリによる酸の中和は塩を生じるため、生成した過剰な塩をサンプルから除去する作業が発生します。
放射性同位元素でラベルした基質を用いる場合には、過剰量の非標識基質による反応停止が有効です。また、反応産物や酵素の熱安定性が明らかな場合は、加熱による反応停止が有効な場合もあります。
反応停止後のサンプルは、変性を避けるために可能な限り速やかに-20℃から-70℃で保存しましょう。
pH変化・反応産物の安定性にも注意しよう
緩衝能が弱いバッファーを反応時間が長い実験に使用すると、インキュベーション中に徐々にpHが変動し、反応効率自体の変化につながる可能性があります。pHのわずかな変動による反応効率の変化を防ぐためには、実験デザインに応じて十分な緩衝能のバッファーを選択することが最も重要です。
また、実験条件によっては、反応の進行に伴う酵素反応産物の分解が起きたり他の物質への変化が生じたりする可能性があります。このような場合は、最終的な反応の結果から初期反応を推定することはできません。たとえば、反応開始後5分あるいは10分の時点での反応の状態は、60分経過したときの状態から推定することはできないのです。酵素反応の時間経過を測定するためには、異なる時点で反応を停止できるように複数の実験を同時に実行するか、単一反応系から各時点でごく微量の反応サンプルを回収して、反応産物を定量してください。
内在性プロテアーゼが存在する細胞抽出液や組織抽出液サンプルの場合は特別な注意が必要です。反応初期に反応に必要な酵素が分解されると、実験誤差の拡大を招くからです。このような場合は、適切なプロテアーゼ阻害剤を使用し、非特異的なプロテアーゼの作用を抑制してください。
最後に、サンプルはすべて使いきらず、少量を保存しておくことをおすすめします。反応の結果を標準化するためには、酵素そのものを分析して、単位酵素活性あたりの酵素重量を計算する必要があるからです。
以上、阻害剤を用いた実験系を構築するときの注意ポイントを紹介しました。気をつけるべきことは多いですが、しっかりとマスターして正確な定量ができるようになりましょう。
<無料PDFダウンロード> 阻害剤 選択ガイド
この阻害剤選択ガイドでは、酵素に対する阻害剤や受容体への阻害剤の作用機序について解説し、適切な阻害剤選びに役立つ情報をご紹介しています。
▼こんな方にオススメ
・最適なプロテインキナーゼ阻害剤を選びたい方
・各種シグナル阻害剤の背景知識を学びたい方
・これから阻害剤を使った実験を行う可能性がある方
下記フォームでは、M-hub(エムハブ)に対してのご意見、今後読んでみたい記事等のご要望を受け付けています。
メルクの各種キャンペーン、製品サポート、ご注文等に関するお問い合わせは下記リンク先にてお願いします。
*入力必須




